题目内容
20.下列说法正确的是( )| A. | 原子的种类由原子核内质子数、中子数决定 | |
| B. | 元素的种类由原子核内质子数、中子数决定 | |
| C. | 32He代表原子核内有2个质子和3个中子的氦原子 | |
| D. | 178O和188O原子的核外电子数是前者大 |
分析 A.质子数和中子数决定原子的种类;
B.质子数决定元素的种类;
C.32He代表原子核内有2个质子和1个中子的氦原子;
D.核外电子数=质子数.
解答 解:A.因质子数和中子数决定原子的种类,则原子的种类由原子核内质子数与中子数共同决定,故A正确;
B.元素是具有相同核电荷数(或核内质子数)的一类原子的总称,所以决定元素种类的是原子的核电荷数或核内质子数,故B错误;
C.32He代表核内质子数为2,中子数=质量数-质子数=3-2=1,故32He代表原子核内有2个质子和1个中子的氦原子,故C错误;
D.178O和188O原子的核外电子数都等于其质子数等于8,故D错误;
故选A.
点评 本题考查粒子间的数量关系以及原子符号的意义,解答本题关键是要知道决定原子核外电子数的是元素的质子数,决定元素种类的是原子的核电荷数或核内质子数,核电荷数等于核内质子数,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.下列有关化学用语表示正确的是( )
| A. | 羟基的电子式 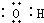 | B. | 丙烯的球棍模型 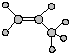 | ||
| C. | 乙炔的电子式  | D. | 乙酸的实验式 C2H4O2 |
8.下列反应的离子方程式不正确的是( )
| A. | Ba(OH)2溶液中加入过量Al2(SO4)3溶液:3Ba2++6OH-+2Al3++3SO42-═3 BaSO4↓+2Al(OH)3↓ | |
| B. | 将少量CO2通入NaClO溶液中:ClO-+CO2+H2O═HCO3-+HClO (已知:次氯酸的Ka为2.95×10-8,碳酸的Ka2为5.6×10-11) | |
| C. | 次氯酸钙溶液中通入足量SO2:Ca2++ClO-+SO2+H2O═CaSO4↓+Cl-+2H+ | |
| D. | 向Ca(OH)2溶液中加入过量的NaHCO3溶液:Ca2++2HCO3-+2OH-═CO32-+CaCO3↓+2H2O |
15.2015年8月12日,天津港大爆炸造成巨量危险化学品NaCN(氰化钠)的部分泄露.泄露的NaCN可用双氧水处理,其化学反应方程式:NaCN+H2O2+H2O=NaHCO3+NH3,下列有关说法正确的是( )
| A. | 0.1molNaCN中含共价键数为0.3NA | |
| B. | 0.1mol/LNaHCO3溶液中HCO3-的数目小于0.1NA | |
| C. | 19gH218O2含有的中子数为12NA | |
| D. | 上述反应中,当有22.4LNH3生成时,转移电子数为0.2NA |
5.下列实验操作或装置(略去部分夹持仪器)正确的是( )
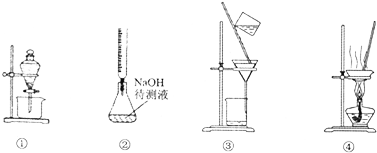

| A. | 图①表示分离CCl4和水的混合溶液的装置 | |
| B. | 图②表示已知浓度的盐酸溶液滴定未知浓度的氢氧化钠溶液的装置 | |
| C. | 图③表示分离二氧化锰和氯化锰溶液的装置 | |
| D. | 图④表示蒸干氯化铝溶液制AlCl3的装置 |
6.下列叙述正确的是( )
| A. | 将铜片放入浓硫酸中,无明显实验现象,说明铜在冷的浓硫酸中发生钝化 | |
| B. | 油脂制肥皂实验中加乙醇的目的是增大油脂的溶解度从而加快油脂皂化反应速率 | |
| C. | 工业合成氨的反应属于能自发进行的反应,故能迅速发生 | |
| D. | 鸡蛋清溶液中加入饱和Na2SO4溶液有沉淀生成是因为蛋白质变性 |
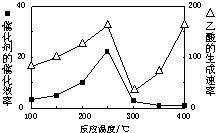 CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.