题目内容
1.短周期主族元素A、B、C、D的原子序数依次增大,其中A、C同主族,B、C、D同周期,A原子的最外层电子数是次外层电子数的3倍,B元素的离子具有黄色的焰色反应,试回答下列问题:(1)A的元素符号O;B的元素名称钠;
(2)D的在周期表中的位置是第三周期第ⅦA族;C、D氢化物较不稳定的化学式是H2S.
(3)A、B、C三种元素形成的简单离子的半径由大到小的顺序是S2->O2->Na+.
(4)B与A形成的化合物B2A2的化学式是Na2O2,其含有的化学键的类型为离子键.共价键
(5)CA2与D元素的单质在水溶液中反应的化学方程式是SO2+Cl2+2H2O═2HCl+H2SO4.
分析 A原子的最外层电子数是次外层电子数的3倍,则A为O元素;B元素的离子具有黄色的焰色反应,则B为Na元素,短周期主族元素A、B、C、D的原子序数依次增大,其中A、C同主族,则C为S元素;B、C、D同周期,则D为Cl元素,由此分析解答.
解答 解:A原子的最外层电子数是次外层电子数的3倍,则A为O元素;B元素的离子具有黄色的焰色反应,则B为Na元素,短周期主族元素A、B、C、D的原子序数依次增大,其中A、C同主族,则C为S元素;B、C、D同周期,则D为Cl元素,
(1)A的元素符号O;B的元素名称是钠,故答案为:O;钠;
(2)Cl是17号元素,氯在周期表中的位置是第三周期第ⅦA族,非金属性越强对应氢化物越稳定,非金属性Cl>S,所以硫化氢不稳定,故答案为:第三周期第ⅦA族;H2S;
(3)电子层数越多半径越大,电子层数相同核电荷数越多半径越小,所以A、B、C三种元素形成的简单离子的半径由大到小的顺序是S2->O2->Na+,故答案为:S2->O2->Na+;
(4)B与A形成的化合物B2A2的化学式是Na2O2,Na-O离子键和O-O共价键,故答案为:Na2O2;离子键、共价键;
(5)二氧化硫与氯水反应生成盐酸和硫酸,反应的化学方程式为:SO2+Cl2+2H2O═2HCl+H2SO4,故答案为:SO2+Cl2+2H2O═2HCl+H2SO4.
点评 本题以原子结构与位置关系为载体,考查化学用语、物质结构、半径比较等,难度中等,推断元素是解题关键,是对所学知识的综合运用,注意基础知识的理解掌握.

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
13.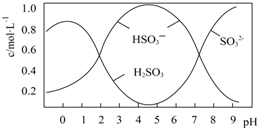 葡萄酒常用Na2S2O5做抗氧化剂,25℃时,将0.5molNa2S2O5溶于水配成1L溶液,该溶液pH=4.5,溶液中部分微粒不正确的是( )
葡萄酒常用Na2S2O5做抗氧化剂,25℃时,将0.5molNa2S2O5溶于水配成1L溶液,该溶液pH=4.5,溶液中部分微粒不正确的是( )
 葡萄酒常用Na2S2O5做抗氧化剂,25℃时,将0.5molNa2S2O5溶于水配成1L溶液,该溶液pH=4.5,溶液中部分微粒不正确的是( )
葡萄酒常用Na2S2O5做抗氧化剂,25℃时,将0.5molNa2S2O5溶于水配成1L溶液,该溶液pH=4.5,溶液中部分微粒不正确的是( )| A. | Na2S2O5溶于水的化学方程式:Na2S2O5+H2O=2NaHSO3 | |
| B. | 由图形可知,25℃时,HSO3-的水解平衡常数约为10-12 | |
| C. | 当溶液pH小于0.5后,图中曲线变化的原因可能是H2SO3被部分氧化 | |
| D. | 向溶液中加入碱性物质使溶液pH升高的过程中,一定存在如下关系:c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-) |
20.下列说法正确的是( )
| A. | 原子的种类由原子核内质子数、中子数决定 | |
| B. | 元素的种类由原子核内质子数、中子数决定 | |
| C. | 32He代表原子核内有2个质子和3个中子的氦原子 | |
| D. | 178O和188O原子的核外电子数是前者大 |
6.已知300℃、70MPa下由二氧化碳和氢气合成乙醇的反应成为现实:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H<0.在温度为T℃,容积不变的V L密闭容器中,将3mol H2和1mol CO2混合,达到平衡时乙醇气体的体积分数为a,下列有关说法正确的是( )
| A. | 升高温度,该反应的平衡常数将增大 | |
| B. | 从平衡混合气中分离出水蒸气可提高CO2和H2的利用率 | |
| C. | 再向该容器中充入2 mol H2和1 mol CO2,达到平衡时,H2的转化率将小于CO2 | |
| D. | T℃,在起始体积为V L的密闭容器(容积可变,恒压)中将3 mol H2和1 mol CO2混合,达到平衡时乙醇体积分数大于a |
10.下列实验原理、实验操作及结论正确的是( )
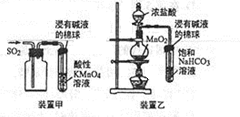

| A. | 用装置甲收集SO2并验证其漂白性 | |
| B. | 用装置乙验证氯气与水反应有盐酸生成 | |
| C. | 用澄清石灰水鉴别苏打溶液和小苏打溶液,出现白色沉淀的为苏打溶液 | |
| D. | 向足量含淀粉的Fel2溶液中滴加2滴新制氯水,溶液变蓝,说明还原性:I->Fe2+ |
11.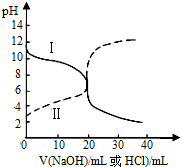 25℃时,取浓度均为0.1mol•L-1的醋酸溶液和氨水溶液各20mL,分别用0.1mol•L-1NaOH溶液、0.1mol•L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法正确的是( )
25℃时,取浓度均为0.1mol•L-1的醋酸溶液和氨水溶液各20mL,分别用0.1mol•L-1NaOH溶液、0.1mol•L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法正确的是( )
 25℃时,取浓度均为0.1mol•L-1的醋酸溶液和氨水溶液各20mL,分别用0.1mol•L-1NaOH溶液、0.1mol•L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法正确的是( )
25℃时,取浓度均为0.1mol•L-1的醋酸溶液和氨水溶液各20mL,分别用0.1mol•L-1NaOH溶液、0.1mol•L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法正确的是( )| A. | 曲线Ⅰ:滴加溶液到10 mL时:c(NH4+)>c(NH3•H2O)>c(Cl-)>c(OH-)>c(H+) | |
| B. | 曲线Ⅱ:滴加溶液到20 mL时:2c(CH3COO-)+c(CH3COOH)+c(OH-)═2c(Na+)+c(H+) | |
| C. | 根据滴定曲线,可得Kb(NH3•H2O)≈10-13 | |
| D. | 由曲线Ⅱ可知,选用酚酞和选用甲基橙作指示剂,消耗NaOH溶液的体积相同 |
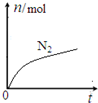 某离子反应中涉及到H、O、Cl、N四种元素形成的六种微粒,N2、H2O、ClO-、H+、NH4+、Cl-,其中N2的物质的量随时间变化的曲线如图所示:
某离子反应中涉及到H、O、Cl、N四种元素形成的六种微粒,N2、H2O、ClO-、H+、NH4+、Cl-,其中N2的物质的量随时间变化的曲线如图所示: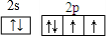 ,该化学用语不能表达出氧原子最外层电子的c(填序号).
,该化学用语不能表达出氧原子最外层电子的c(填序号).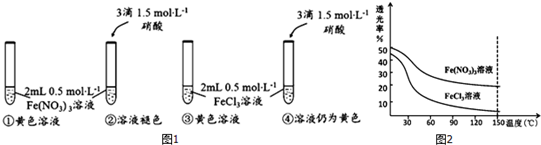
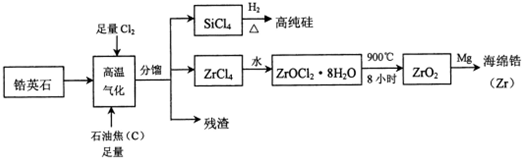
 .
.