题目内容
5.12克铜和一定质量的硝酸反应,当铜消耗完时,共收集到标准状况下的气体3.36升,若把装有这些气体的集气瓶倒立在盛水的水槽中,需通入多少升标准状况下的氧气才能使集气瓶充满溶液.( )
| A、0.336升 |
| B、0.224升 |
| C、0.896升 |
| D、1.12升 |
考点:化学方程式的有关计算
专题:计算题
分析:铜与一定量质量的硝酸反应,得到硝酸铜和氮的氧化物的混合气体,混合气体倒立水中,通入O2后又生成硝酸,若使集气瓶充满溶液,氮的氧化物全部转化为硝酸,纵观整个过程,Cu失去的电子等于氧气获得的电子,根据电子转移守恒计算需要氧气物质的量,再根据V=nVm计算氧气体积.
解答:
解:铜与一定量质量的硝酸反应,得到硝酸铜和氮的氧化物的混合气体,混合气体倒立水中,通入O2后又生成硝酸,若使集气瓶充满溶液,氮的氧化物全部转化为硝酸,纵观整个过程,Cu失去的电子等于氧气获得的电子,5.12gCu的物质的量为
=0.08mol,根据电子转移守恒,可知需要氧气物质的量为
=0.04mol,故需要氧气体积为0.04mol×22.4L/mol=0.896L,
故选C.
| 5.12g |
| 64g/mol |
| 0.08mol×2 |
| 4 |
故选C.
点评:本题考查化学方程式计算、氧化还原反应计算,本题利用守恒法解答,避免利用方程式计算的繁琐,侧重考查学生分析思维能力,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列关于糖类的说法正确的是( )
| A、所有糖类物质都有甜味,但不一定都溶于水 |
| B、葡萄糖和果糖性质不同,但分子式相同 |
| C、葡萄糖和蔗糖不是同分异构体,但属于同系物 |
| D、葡萄糖、果糖和蔗糖都能发生水解反应 |
为逐一分离试样X中的Na+、Ba2+、Cu2+、Ag+等四种阳离子,对该试样进行的实验设计如下:
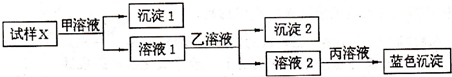
有关甲、乙、丙的选择有以下四种方案:
①H2SO4、HCl、NaOH;②NaCl、Na2SO4、NaOH;③NaCl、Na2CO3、NaOH;④HCl、H2SO4、NaOH.
能达到实验目的是( )

有关甲、乙、丙的选择有以下四种方案:
①H2SO4、HCl、NaOH;②NaCl、Na2SO4、NaOH;③NaCl、Na2CO3、NaOH;④HCl、H2SO4、NaOH.
能达到实验目的是( )
| A、①③ | B、①④ | C、②③ | D、②④ |
向一定量的铁铝合金加入足量的稀盐酸,充分反应后,生成标况下的H2672mL,将等量的合金投入到足量的稀硝酸中,完全反应后,被还原的HNO3的物质的量为(假设还原产物是NO)( )
| A、0.03mol |
| B、0.02mol |
| C、大于0.02mol |
| D、小于0.02mol |
实验是解决化学问题的基本途径,下列有关实验的叙述不正确的是( )
| A、240 mL 0.2 mol?L-1的NaCl溶液配制:需要使用天平、250 mL容量瓶等仪器 |
| B、向FeCl3稀溶液中滴加NaOH溶液,并加热煮沸,可制备Fe(OH)3胶体 |
| C、不慎将NaOH溶液溅到皮肤上,应立即用较多的水冲洗 |
| D、用苯萃取碘水中的碘时,萃取后的油层不能从分液漏斗下端放出 |
 有X、Y、Z、T、U五种短周期元素.X、Y、Z三元素在周期表中的位置如图所示,三元素的原子序数之和是41.X和T的单质在不同条件下反应,可以生成T2X(白色固体)和T2X2(淡黄色固体)两种化合物.U单质在Z单质中燃烧时产生苍白色火焰,生成物的水溶液能使石蕊试液变红.
有X、Y、Z、T、U五种短周期元素.X、Y、Z三元素在周期表中的位置如图所示,三元素的原子序数之和是41.X和T的单质在不同条件下反应,可以生成T2X(白色固体)和T2X2(淡黄色固体)两种化合物.U单质在Z单质中燃烧时产生苍白色火焰,生成物的水溶液能使石蕊试液变红.