题目内容
下列说法正确的是( )
| A、制备硫酸亚铁铵的实验中最后制得的晶体过滤后用蒸馏水洗涤 |
| B、AgI 沉淀中滴入稀KCl溶液,有白色沉淀出现,说明AgCl比AgI更难溶 |
| C、倾析法是将不溶物充分沉淀后,先转移沉淀后转移液体 |
| D、配制好的氢氧化钠溶液用邻苯二甲酸氢钾滴定浓度时,采用酚酞为指示剂 |
考点:化学实验方案的评价
专题:
分析:A.硫酸亚铁铵易溶于水,难溶于酒精,使用无水乙醇洗涤,防止晶体溶解损失;
B.c(Cl-)×c(Ag+)>Ksp(AgCl),则生成沉淀;
C.当沉淀的颗粒较大时,也可用倾析法将固体和溶液分离;
D.酚酞遇碱变红色,中性或酸性为无色.
B.c(Cl-)×c(Ag+)>Ksp(AgCl),则生成沉淀;
C.当沉淀的颗粒较大时,也可用倾析法将固体和溶液分离;
D.酚酞遇碱变红色,中性或酸性为无色.
解答:
解:A.硫酸亚铁铵易溶于水,难溶于酒精,使用无水乙醇代替水进行洗涤,主要是为了防止硫酸亚铁铵晶体溶解损失,故A错误;
B.AgI沉淀中滴入浓KCl溶液,若c(Cl-)×c(Ag+)>Ksp(AgCl),则生成白色沉淀,但AgI比AgCl更难溶,故B错误;
C.当沉淀的颗粒较大时,也可用倾析法将固体和溶液分离,先转移液体,故C错误;
D.酚酞遇碱变红色,中性或酸性为无色,可做指示剂,故D正确.
故选D.
B.AgI沉淀中滴入浓KCl溶液,若c(Cl-)×c(Ag+)>Ksp(AgCl),则生成白色沉淀,但AgI比AgCl更难溶,故B错误;
C.当沉淀的颗粒较大时,也可用倾析法将固体和溶液分离,先转移液体,故C错误;
D.酚酞遇碱变红色,中性或酸性为无色,可做指示剂,故D正确.
故选D.
点评:本题考查化学实验方案的评价,为高频考点,涉及物质检验及分离与提纯等,侧重实验基本操作和实验原理的考查,注意装置的作用及实验的操作性、评价性分析,题目难度不大.

练习册系列答案
相关题目
化学史中许多科学家创建的理论对化学的发展起到重大作用.下列有关科学家及其创建理论的描述中,错误的是( )
| A、拉瓦锡阐明了质量守恒定律 |
| B、道尔顿创立分子学说 |
| C、门捷列夫发现了元素周期律 |
| D、勒沙特列发现化学平衡移动原理 |
对于  分子,下列说法正确的是( )
分子,下列说法正确的是( )
 分子,下列说法正确的是( )
分子,下列说法正确的是( )| A、处于同一直线的碳原子共有9个 |
| B、处于同一平面的碳原子至少有9个 |
| C、处于同一直线的碳原子最多有10个 |
| D、处于同一平面的原子最多有21个 |
甲、乙两烧杯中分别装有相同体积、相同pH的氨水和NaOH溶液,各加入10mL0.1mol?L-1 AlCl3溶液,两烧杯中都有沉淀生成.下列判断正确的是( )
| A、甲中沉淀一定比乙中的多 |
| B、甲中沉淀可能比乙中的少 |
| C、甲中沉淀一定比乙中的少 |
| D、甲中和乙中的沉淀可能一样多 |
下列离子方程式书写正确的是( )
| A、10mL0.5mol/L的明矾溶液与10mL0.5mol/LBa(OH)2溶液混合反应:3Ba2++6OH-+2Al3++3SO42-=3BaSO4↓+2Al(OH)3↓ | ||||
| B、标况下22.4LCO2通入含1molCa(ClO)2的溶液中:ClO-+CO2+H2O=HCO3-+HClO | ||||
| C、1mol氢氧化铁沉淀中加入含3molHI的氢碘酸:Fe(OH)3+3H+=Fe3++3H2O | ||||
D、用铜做电极电解氯化铜溶液:Cu2++2Cl-
|
根据稳定岛假说,元素周期表的最终界限可能在175号元素左右,科学家预测114号元素位于第七周期ⅣA族,下列有关此元素的预测中,正确的是( )
| A、它为非金属 |
| B、其离子比Cu2+离子的氧化性强 |
| C、其低价氧化物是酸性氧化物 |
| D、它有+2价与+4价 |
 ,物质A在体内脱氢酶的作用下会氧化为有害物质GHB.下图是关于物质A的一种制备方法及由A引发的一系列化学反应.
,物质A在体内脱氢酶的作用下会氧化为有害物质GHB.下图是关于物质A的一种制备方法及由A引发的一系列化学反应.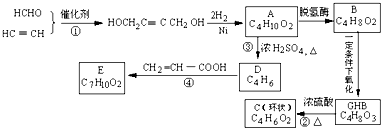
 结构),它的结构简式为
结构),它的结构简式为