题目内容
某同学为了探究外界条件对化学反应速率的影响,用50mL稀盐酸和1g碳酸钙在不同条件下反应,得到如下表数据.请仔细观察下表中实验数据,回答下列问题:
(1)该反应属于 反应(填“吸热”或“放热).
(2)实验5、6目的是探究 对反应速率的影响,结果说明当其他条件相同时, ,反应速率越快.
(3)根据实验1、3、5或实验2、4可以得出条件对反应速率的影响规律是 .
(4)从本实验数据中分析,影响化学反应速率的因素还有 ,能表明这一规律的两个实验序号是 .
| 实验 序号 | 碳酸钙 状态 | C(HCl)/ mol?L-1 | 溶液温度/℃ | 碳酸钙消失 时间/s | |
| 反应前 | 反应后 | ||||
| 1 | 块状 | 0.5 | 20 | 39 | 400 |
| 2 | 粉末 | 0.5 | 20 | 40 | 60 |
| 3 | 块状 | 0.6 | 20 | 41 | 280 |
| 4 | 粉末 | 0.8 | 20 | 40 | 30 |
| 5 | 块状 | 1.0 | 20 | 40 | 120 |
| 6 | 块状 | 1.0 | 30 | 50 | 40 |
(2)实验5、6目的是探究
(3)根据实验1、3、5或实验2、4可以得出条件对反应速率的影响规律是
(4)从本实验数据中分析,影响化学反应速率的因素还有
考点:探究影响化学反应速率的因素
专题:化学反应速率专题
分析:影响反应速率的因素有固体表面积、溶液的浓度、温度、压强以及催化剂等,解答本题时注意从几个变量的对比①固体的状态,②盐酸的浓度,③温度的变化,④反应时间等,通过对比可得出不同外界条件对化学反应速率的影响,以此解答该题.
解答:
解:(1)通过表中数据,对比反应前后温度变化可知,反应后溶液温度升高,则反应为放热反应,反应的离子方程式为CaCO3+2H+=Ca2++CO2↑+H2O,
故答案为:放热;
(2)由实验5和6实验数据可知,其他条件相同时,温度越高,碳酸钙消失的所用时间越少,说明温度越高,反应速率越大,
故答案为:温度;温度越高;
(3)实验1、3、5相同的地方是固体的形状相同,反应前的温度相同,但反应物的浓度依次增大,碳酸钙消失的所用时间依次减少,说明反应物浓度越大,反应速率越快,
故答案为:其它条件一定,反应物浓度越大,反应速率越快;
(4)1、2数据反应温度相同,盐酸的浓度相同,但固体的形状不同,实验数据标明粉末时的反应速率大于粒状,则可说明接触面积越大,反应速率越大,
故答案为:反应物的接触面积;1和2.
故答案为:放热;
(2)由实验5和6实验数据可知,其他条件相同时,温度越高,碳酸钙消失的所用时间越少,说明温度越高,反应速率越大,
故答案为:温度;温度越高;
(3)实验1、3、5相同的地方是固体的形状相同,反应前的温度相同,但反应物的浓度依次增大,碳酸钙消失的所用时间依次减少,说明反应物浓度越大,反应速率越快,
故答案为:其它条件一定,反应物浓度越大,反应速率越快;
(4)1、2数据反应温度相同,盐酸的浓度相同,但固体的形状不同,实验数据标明粉末时的反应速率大于粒状,则可说明接触面积越大,反应速率越大,
故答案为:反应物的接触面积;1和2.
点评:本题考查了外界条件对反应速率影响的实验探究,题目难度不大,注意培养对图表数据的分析能力.

练习册系列答案
相关题目
下列实验描述正确的是( )
| A、在制备硝酸钾晶体实验中先常温减压过滤,后高温常压过滤 |
| B、在中和热测定的实验中,将氢氧化钠和盐酸混合反应后的最高温度作为末温度 |
| C、火柴头中的氯元素检验的实验中,将火柴头(未燃烧)浸于水中,片刻后取少量溶液,加AgNO3溶液、稀硝酸,若出现白色沉淀,证明有氯元素 |
| D、原电池实验中,可以往电解质溶液中加入一些还原剂增强电池的放电效果(去极化作用) |
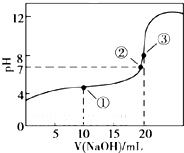 常温下,用0.1mol/L溶液滴定20mL 0.1mol/L CH3COOH溶液的滴定曲线如图.下列说法正确的是( )
常温下,用0.1mol/L溶液滴定20mL 0.1mol/L CH3COOH溶液的滴定曲线如图.下列说法正确的是( )| A、滴定过程中不可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
| B、点①所示溶液中c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) |
| C、点②所示溶液中c(CH3COOH)>c(Na+)=c(CH3COO-)>c(H+)=c(OH-) |
| D、点③所示溶液中c(Na+)+c(H+)=c(CH3COOH)+c(OH-) |
下列说法正确的是( )
| A、制备硫酸亚铁铵的实验中最后制得的晶体过滤后用蒸馏水洗涤 |
| B、AgI 沉淀中滴入稀KCl溶液,有白色沉淀出现,说明AgCl比AgI更难溶 |
| C、倾析法是将不溶物充分沉淀后,先转移沉淀后转移液体 |
| D、配制好的氢氧化钠溶液用邻苯二甲酸氢钾滴定浓度时,采用酚酞为指示剂 |
已知25℃时溶解度:AgCl>AgI,若在5mL含有KCl和KI各为0.01mol/L的溶液中,加入8mL0.01mol/LAgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是( )
| A、c (K+)>c (NO3-)>c (Ag+)=c (Cl-)+c (I-) |
| B、c (K+)>c (NO3-)>c (Ag+)>c (Cl-)>c (I-) |
| C、c (NO3-)>c (K+)>c (Ag+)>c (Cl-)>c (I-) |
| D、c (K+)>c (NO3-)>c (Cl-)>c (Ag+)>c (I-) |

 如图所示,当关闭K时,向A(恒容)中充入1mol X、1mol Y,向B(带有活塞)中充入2mol X、2mol Y,起始时,V(A)=V(B)=aL.在相同温度和催化剂存在的条件下,两容器中各自发生下列反应:2X(g)+2Y(g)?Z(g)+2W(g)△H<0,达到平衡(Ⅰ)时,V(B)=0.8aL.请回答:
如图所示,当关闭K时,向A(恒容)中充入1mol X、1mol Y,向B(带有活塞)中充入2mol X、2mol Y,起始时,V(A)=V(B)=aL.在相同温度和催化剂存在的条件下,两容器中各自发生下列反应:2X(g)+2Y(g)?Z(g)+2W(g)△H<0,达到平衡(Ⅰ)时,V(B)=0.8aL.请回答: