题目内容
17.下列离子方程式书写正确的是( )| A. | 在100 mL浓度为1 mol•L-1的 Fe(NO3)3的溶液中通入足量SO2:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | |
| B. | 在100 mL浓度为2 mol•L-1的FeI2的溶液中通入标准状况下5.6 L的Cl2:4Fe2++6I-+5Cl2═4Fe3++3I2+10Cl- | |
| C. | 向NaHCO3溶液中加入过量的澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- | |
| D. | 向明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O |
分析 A.硝酸根离子在酸性条件下能够氧化二氧化硫;
B.根据n=$\frac{V}{{V}_{m}}$计算出氯气的物质的量,碘离子还原性较强,优先与氯气反应,剩余的氯气再与亚铁离子反应;
C.石灰水过量,所有的碳酸根离子都转化成碳酸钙沉淀;
D.氢氧化钡过量,反应生成硫酸钡沉淀、偏铝酸钾和水.
解答 解:A.在100 mL浓度为1 mol•L-1的 Fe(NO3)3的溶液中通入足量SO2,硝酸根离子也参与反应,正确的离子方程式为:3NO3-+Fe3++5SO2+4H2O═Fe2++5SO42-+8H++3NO↑,故A错误;
B.在100 mL浓度为2 mol•L-1的FeI2的溶液中通入标准状况下5.6 L的Cl2,氯气的物质的量为:$\frac{5.6L}{22.4L/mol}$=0.25mol,碘化亚铁的物质的量为0.2mol,碘离子还原性大于亚铁离子,则碘离子优先反应,0.4mol碘离子完全反应消耗0.2mol氯气,说明氯气恰好反应,正确的反应为:2I-+Cl2═I2+2Cl-,故B错误;
C.NaHCO3溶液中加入过量的澄清石灰水,反应生成碳酸钙沉淀、氢氧化钠和水,正确的离子方程式为:HCO3-+Ca2++OH-═CaCO3↓+H2O,故C错误;
D.明矾溶液中加入过量的氢氧化钡溶液,反应的离子方程式为:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O,故D正确;
故选D.
点评 本题考查了离子方程式的书写判断,题目难度中等,侧重考查反应物过量对生成物影响,明确离子方程式的书写原则为解答关键,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
7.有关化学用语正确的是( )
| A. | 溴乙烷的分子式C2H5Br | B. | 乙醇的结构简式C2H6O | ||
| C. | 四氯化碳的电子式  | D. | 乙烯的最简式C2H4 |
8.工业上将Na2CO3和Na2S以物质的量1:2之比配成溶液,通入SO2,可制取Na2S2O3,同时放出CO2,该反应中( )
| A. | 硫元素既被氧化又被还原 | |
| B. | 氧化剂与还原剂的物质的量之比为1:2 | |
| C. | 每生成1molNa2S2O3,转移4mol电子 | |
| D. | 相同条件下,每吸收10m3SO2就会放出2m3CO2 |
2.下列有关表达不正确的是( )
| A. | 符号为${\;}_8^{18}$O的原子常用于文物年代的测定 | |
| B. | 原子结构示意图 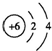 既可以表示12C,也可以表示14C 既可以表示12C,也可以表示14C | |
| C. | 具有16个质子、16个中子和18个电子的微粒是${\;}_{16}^{32}$S2- | |
| D. | “84消毒液”中有效成分NaClO的电子式为  |
9.在化学反应中,反应前与反应后相比较,肯定不变的是( )
①元素的种类 ②原子的种类 ③分子数目 ④原子数目
⑤反应前物质的质量总和与反应后物质的质量总和 ⑥反应前反应物的总能量与反应后生成物的总能量.
①元素的种类 ②原子的种类 ③分子数目 ④原子数目
⑤反应前物质的质量总和与反应后物质的质量总和 ⑥反应前反应物的总能量与反应后生成物的总能量.
| A. | ①②③④ | B. | ①②⑤⑥ | C. | ①②④⑤ | D. | ②③⑤⑥ |
6.除去下列括号内杂质的试剂或方法错误的是( )
| A. | HNO3溶液(H2SO4),适量BaCl2溶液,过滤 | |
| B. | CO2(SO2),酸性KMnO4溶液、浓硫酸,洗气 | |
| C. | FeCl2溶液(FeCl3),铁粉,过滤 | |
| D. | CO(CO2),氢氧化钠溶液,洗气 |
7.把一定浓度的NaOH溶液分成两等份,一份密闭保存,另一份敞口放置,几天后分别与相同浓度的盐酸反应,都恰好完全反应时,若第一份用去盐酸V1mL,第二份用去盐酸V2mL,则两者的关系为( )
| A. | V1=V2 | B. | V1>V2 | C. | V1<V2 | D. | 不能确定 |