题目内容
7.把一定浓度的NaOH溶液分成两等份,一份密闭保存,另一份敞口放置,几天后分别与相同浓度的盐酸反应,都恰好完全反应时,若第一份用去盐酸V1mL,第二份用去盐酸V2mL,则两者的关系为( )| A. | V1=V2 | B. | V1>V2 | C. | V1<V2 | D. | 不能确定 |
分析 氢氧化钠敞口放置,则2NaOH+CO2=Na2CO3+H2O,Na2CO3+2HCl=2NaCl+H2O+CO2↑;氢氧化钠和盐酸反应生成氯化钠和水NaOH+HCl=NaCl+H2O,根据钠元素守恒、氯元素守恒计算二者消耗盐酸的体积.
解答 解:氢氧化钠敞口放置,则则2NaOH+CO2=Na2CO3+H2O,Na2CO3+2HCl=2NaCl+H2O+CO2↑;氢氧化钠和盐酸反应生成氯化钠和水NaOH+HCl=NaCl+H2O,根据钠元素守恒,氢氧化钠中和碳酸钠中钠离子的物质的量是相等的,再和盐酸反应,都得到的是氯化钠溶液,n(Na+)=n(Cl-),根据氯元素守恒,所以二者消耗的盐酸的物质的量是相等的,即用相同浓度的盐酸的体积是一样多的.
故选A.
点评 本题考查学生元素化合物的性质以及方程式的计算知识,注意元素守恒思想在解题中的应用是关键,难度中等.

练习册系列答案
相关题目
17.下列离子方程式书写正确的是( )
| A. | 在100 mL浓度为1 mol•L-1的 Fe(NO3)3的溶液中通入足量SO2:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | |
| B. | 在100 mL浓度为2 mol•L-1的FeI2的溶液中通入标准状况下5.6 L的Cl2:4Fe2++6I-+5Cl2═4Fe3++3I2+10Cl- | |
| C. | 向NaHCO3溶液中加入过量的澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- | |
| D. | 向明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O |
15.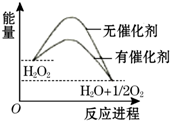 已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如图所示.下列说法正确的是( )
已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如图所示.下列说法正确的是( )
 已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如图所示.下列说法正确的是( )
已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如图所示.下列说法正确的是( )| A. | 加入催化剂,减小了反应的热效应 | |
| B. | 加入催化剂,可提高H2O2的平衡转化率 | |
| C. | H2O2分解的热效应△H<0 | |
| D. | 反应物的总能量高于生成物的总能量 |
19.物质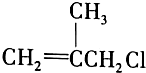 是药品的中间体,属可疑人类致癌物,针对该有机物的描述中,正确的有( )
是药品的中间体,属可疑人类致癌物,针对该有机物的描述中,正确的有( )
①能使Br2的CCl4溶液褪色 ②能使酸性KMnO4溶液褪色 ③在一定条件下可以聚合成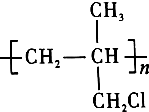
④在NaOH溶液中加热可以生成不饱和醇类 ⑤在NaOH的醇溶液中加热,可发生消去反应 ⑥与AgNO3溶液反应生成白色沉淀.
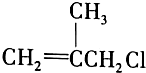 是药品的中间体,属可疑人类致癌物,针对该有机物的描述中,正确的有( )
是药品的中间体,属可疑人类致癌物,针对该有机物的描述中,正确的有( )①能使Br2的CCl4溶液褪色 ②能使酸性KMnO4溶液褪色 ③在一定条件下可以聚合成
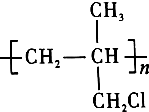
④在NaOH溶液中加热可以生成不饱和醇类 ⑤在NaOH的醇溶液中加热,可发生消去反应 ⑥与AgNO3溶液反应生成白色沉淀.
| A. | ①②③④ | B. | ⑤⑥ | C. | ②④⑥ | D. | 全部 |
13.为了测定铁铜合金的组成,将7.6g铁、铜合金加入100mL某浓度的稀硝酸中,将合金完全溶解后,共收集到NO气体2.24L(标准状况下),并测得溶液中H+的浓度为0.5mol•L-1,若反应前后溶液的体积变化忽略不计,则下列判断正确的是( )
| A. | 上述反应中金属共失去电子0.1mol | |
| B. | 合金中,铜的质量为2.8g | |
| C. | 原硝酸的浓度:c(HNO3)=4.5mol•L-1 | |
| D. | 要使溶液中的金属离子完全沉淀,需加5mol•L-1的NaOH溶液60mL |