题目内容
8.工业上将Na2CO3和Na2S以物质的量1:2之比配成溶液,通入SO2,可制取Na2S2O3,同时放出CO2,该反应中( )| A. | 硫元素既被氧化又被还原 | |
| B. | 氧化剂与还原剂的物质的量之比为1:2 | |
| C. | 每生成1molNa2S2O3,转移4mol电子 | |
| D. | 相同条件下,每吸收10m3SO2就会放出2m3CO2 |
分析 工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2,其反应方程式为2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2,反应在S元素的化合价从-2价升高到+2价,S的化合价从+4价降低到+2价,以此来解答.
解答 解:A.由2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2中S元素的化合价变化可知,硫元素既被氧化又被还原,故A正确;
B.2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2中,Na2S为还原剂,SO2为氧化剂,则氧化剂与还原剂的物质的量之比为2:1,故B错误;
C.反应中2Na2S转化为3Na2S2O3,转移8个电子,则生成1molNa2S2O3,转移$\frac{8}{3}$mol电子,故C错误;
D.根据方程式可知,每吸收4mol SO2就会放出1molCO2,则每吸收1mol SO2就会放出0.25molCO2,Vm未知不能计算其体积,故D错误;
故选A.
点评 本题考查氧化还原反应及计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意从元素的化合价角度分析,题目难度不大.

练习册系列答案
相关题目
18.下列装置,可达到铁片上镀锌目的是( )
| A. |  含Fe2+电镀液 | B. |  含Fe2+电镀液 | C. |  含Zn2+电镀液 | D. |  含Zn2+电镀液 |
19.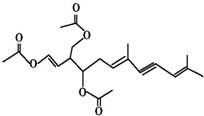 绿藻的胶质中分离出一种有机化合物(用A表示),结构如图所示,A对人体无害,可用于新鲜食品中对脂肪酶进行抑制来保持风味,也可外用使伤口快速愈合.则关于该物质的说法中错误的有( )
绿藻的胶质中分离出一种有机化合物(用A表示),结构如图所示,A对人体无害,可用于新鲜食品中对脂肪酶进行抑制来保持风味,也可外用使伤口快速愈合.则关于该物质的说法中错误的有( )
 绿藻的胶质中分离出一种有机化合物(用A表示),结构如图所示,A对人体无害,可用于新鲜食品中对脂肪酶进行抑制来保持风味,也可外用使伤口快速愈合.则关于该物质的说法中错误的有( )
绿藻的胶质中分离出一种有机化合物(用A表示),结构如图所示,A对人体无害,可用于新鲜食品中对脂肪酶进行抑制来保持风味,也可外用使伤口快速愈合.则关于该物质的说法中错误的有( )| A. | 该物质的化学式为C21H26O6 | |
| B. | 该物质中含有两个手性碳原子 | |
| C. | 1 mol 该物质最多能消耗5 mol H2和3 mol NaOH | |
| D. | 该物质能发生加成反应、取代反应、氧化反应 |
16.既能发生银镜反应、又能发生水解反应的是( )
| A. | 葡萄糖 | B. | 麦牙糖 | C. | 淀粉 | D. | 蔗塘 |
3.下列说法错误的是( )
| A. | 胶体粒子能透过滤纸,但不能透过半透膜 | |
| B. | 胶体和溶液的本质区别在于分散质粒子大小 | |
| C. | 蛋清、豆浆、墨水都是胶体 | |
| D. | 丁达尔效应是化学变化 |
17.下列离子方程式书写正确的是( )
| A. | 在100 mL浓度为1 mol•L-1的 Fe(NO3)3的溶液中通入足量SO2:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | |
| B. | 在100 mL浓度为2 mol•L-1的FeI2的溶液中通入标准状况下5.6 L的Cl2:4Fe2++6I-+5Cl2═4Fe3++3I2+10Cl- | |
| C. | 向NaHCO3溶液中加入过量的澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- | |
| D. | 向明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O |