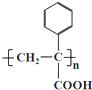
题目内容
1.下列物质变化时,不需要破坏化学键的是( )| A. | HCl溶于水 | B. | 烧碱熔化 | C. | H2燃烧 | D. | I2升华 |
分析 化学变化中一定破坏化学键,离子化合物、共价化合物的电离破坏化学键,而分子晶体升华只破坏分子间作用力,以此来解答.
解答 解:A.氯化氢溶于水,发生电离,H-Cl共价键破坏,故A不选;
B.烧碱融化破坏离子键,故B不选;
C.氢气燃烧生成水,发生化学变化,化学键一定破坏,故C不选;
D.固体碘升华,只破坏分子间作用力,不破坏化学键,故D选;
故选D.
点评 本题考查化学键,为高频考点,把握化学变化中化学键一定被破坏为解答的关键,注意电离破坏化学键不发生化学变化,题目难度不大.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案
相关题目
13.决定化学反应速率的主要因素是( )
| A. | 参加反应的物质本身的性质 | B. | 催化剂 | ||
| C. | 温度 | D. | 反应物的浓度或压强 |
12.某化学课外小组的同学通过实验探究温度和浓度对反应速率的影响.
实验原理及方案:在酸性溶液中,碘酸钾( KIO3)和亚硫酸钠可发生反应生成碘,反应原理是2IO3-+5SO32-+2H+=I2+5SO42-+H2O,生成的碘可用淀粉溶液检验,根据出现蓝色所需的时间来衡量该反应的速率.
(1)V1=40mL,V2=10mL.
(2)从你的理解看最先出现蓝色的一组实验是③ (填序号)
实验原理及方案:在酸性溶液中,碘酸钾( KIO3)和亚硫酸钠可发生反应生成碘,反应原理是2IO3-+5SO32-+2H+=I2+5SO42-+H2O,生成的碘可用淀粉溶液检验,根据出现蓝色所需的时间来衡量该反应的速率.
| 实验 序号 | 0.01mol/L KIO3酸性溶液 (含淀粉)的体积/mL | 0.01mol/L Na2SO3溶 液的体积/mL | 水的体 积/mL | 实验温 度/℃ | 出现蓝色 的时间/s |
| ① | 5 | 5 | V1 | 0 | |
| ② | 5 | 5 | 40 | 25 | |
| ③ | 5 | V2 | 35 | 25 |
(2)从你的理解看最先出现蓝色的一组实验是③ (填序号)
16.下列各烃中沸点最低的是( )
| A. | 庚烷 | B. | 戊烷 | C. | 异戊烷 | D. | 新戊烷 |
13.下列与有机物的结构、性质相关的叙述错误的是( )
| A. | 碳碳双键不可旋转所以烯烃一定有顺反异构 | |
| B. | 由乙烯、乙炔的结构特点可推知CH3-CH=C(CH3)-C≡C-CH3分子中所有的碳原子共面 | |
| C. | 甲烷和氯气反应生成一氯甲烷与苯和硝酸反应生成硝基苯的反应类型相同 | |
| D. | 苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有乙烯分子中类似的碳碳双键 |
10.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 丙烯分子有7个σ键,1个π键 | |
| B. | 由2H和18O所组成的水11g,其中所含的中子数为4NA | |
| C. | 0.1mol SiO2晶体中所含有的硅氧键数目为0.2NA | |
| D. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3mol I2转移的电子数为5NA个 |
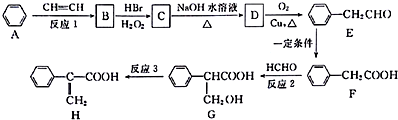
 .
.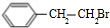 ;②D-E的化学方程式是2
;②D-E的化学方程式是2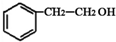 +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2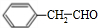 +2H2O;
+2H2O;