题目内容
12.某化学课外小组的同学通过实验探究温度和浓度对反应速率的影响.实验原理及方案:在酸性溶液中,碘酸钾( KIO3)和亚硫酸钠可发生反应生成碘,反应原理是2IO3-+5SO32-+2H+=I2+5SO42-+H2O,生成的碘可用淀粉溶液检验,根据出现蓝色所需的时间来衡量该反应的速率.
| 实验 序号 | 0.01mol/L KIO3酸性溶液 (含淀粉)的体积/mL | 0.01mol/L Na2SO3溶 液的体积/mL | 水的体 积/mL | 实验温 度/℃ | 出现蓝色 的时间/s |
| ① | 5 | 5 | V1 | 0 | |
| ② | 5 | 5 | 40 | 25 | |
| ③ | 5 | V2 | 35 | 25 |
(2)从你的理解看最先出现蓝色的一组实验是③ (填序号)
分析 (1)探究温度和浓度对速率影响时,应考虑在同等条件下研究温度或浓度对速率的影响,即浓度相同时探究温度,温度相同时探究浓度;
(2)根据温度高,反应快,浓度大,反应快,再通过对比得出.
解答 解:(1)①和②温度不同,应该时探究温度对速率的影响,因此浓度要求相同,即溶液的总体积相同,则V1+5+5=5+5+40,得V1=40;②和③温度相同,应该时探究浓度对速率的影响,图表中KIO3酸性溶液体积相同,可知是改变亚硫酸钠的浓度,为达到溶液体积相同,5+V2+35=5+5+40,得V2=10,
故答案为:40;10;
(2)淀粉遇碘变蓝,反应越快,生成碘越快,出现蓝色越快,实验③的温度比实验①高,实验③中Na2SO3溶液的浓度又比实验①②都大,根据温度高,反应快,浓度大,反应快,得出实验③最先出现蓝色,
故答案为:③.
点评 探究型实验为高考高频考点,但基础性较强,理解反应实质是解题关键,难度不大,建议重视基本理论的理解与运用,夯实基础,提高分析问题解决问题的能力.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
2.下列离子方程式属于水解反应,而且可使溶液呈酸性的是( )
| A. | HS-+H2O?S2-+H3O+ | B. | SO3+H2O?HSO4-+H3O+ | ||
| C. | HCO3-+H2O?CO32-+H3O+ | D. | NH4++2H2O?NH3•H2O+H3O+ |
7. 某酸性工业废水中含有K2Cr2O7.光照下,草酸H2C2O4能将其中的Cr2O72-转化为Cr3+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
某酸性工业废水中含有K2Cr2O7.光照下,草酸H2C2O4能将其中的Cr2O72-转化为Cr3+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25°C下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始c(H+)和一定浓度草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格).
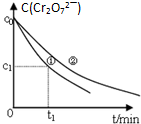
测得实验①和②溶液中的Cr2O72-浓度随时间变化关系如图所示.
(2)上述反应后草酸被氧化为CO2(填化学式).
(3)实验①和②的结果表明c(H+)越大,反应的速率越快;实验①中0~t1时间段反应速率v(Cr3+)=$\frac{2({c}_{0}-{c}_{1})}{{t}_{1}}$mol•L-1•min-1 (用代数式表示).
(4)该课题组对铁明矾[Al2Fe(SO4)4•24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用;假设二:Al3+起催化作用;假设三:SO42-起催化作用;
(5)请你设计实验验证上述假设一,完成表中内容.(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4•Al2(SO4)3•24H2O、Al2(SO4)3等.溶液中Cr2O72-的浓度可用仪器测定)
 某酸性工业废水中含有K2Cr2O7.光照下,草酸H2C2O4能将其中的Cr2O72-转化为Cr3+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
某酸性工业废水中含有K2Cr2O7.光照下,草酸H2C2O4能将其中的Cr2O72-转化为Cr3+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:(1)在25°C下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始c(H+)和一定浓度草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格).
| 实验编号 | 初始c(H+) | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| ① | 1.0×10-4 | 60 | 10 | 30 |
| ② | 1.0×10-5 | 60 | 10 | 30 |
| ③ | 1.0×10-5 | 60 |
(2)上述反应后草酸被氧化为CO2(填化学式).
(3)实验①和②的结果表明c(H+)越大,反应的速率越快;实验①中0~t1时间段反应速率v(Cr3+)=$\frac{2({c}_{0}-{c}_{1})}{{t}_{1}}$mol•L-1•min-1 (用代数式表示).
(4)该课题组对铁明矾[Al2Fe(SO4)4•24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用;假设二:Al3+起催化作用;假设三:SO42-起催化作用;
(5)请你设计实验验证上述假设一,完成表中内容.(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4•Al2(SO4)3•24H2O、Al2(SO4)3等.溶液中Cr2O72-的浓度可用仪器测定)
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
| 用等物质的量的K2SO4•Al2(SO4)3•24H2O代替实验①中的铁明矾,控制其他反应条件与实验①相同,进行对比试验. | 反应进行相同时间后,若溶液中的Cr2O72-浓度大于实验①中Cr2O72-浓度,则假设一成立;若两溶液中的Cr2O72-浓度相同,则假设一不成立. |
17.某研究性学习小组为了研究影响化学反应速率的因素,设计如下方案:
已知:反应的方程式(未配平):KMnO4+H2C2O4+H2SO4--K2SO4+MnSO4+CO2↑+H2O
(1)实验记时方法是从溶液混合开始记时,至溶液紫红色刚好褪去时记时结束.
(2)实验Ⅰ和Ⅱ研究浓度对反应速率的影响,实验Ⅰ和Ⅲ研究温度对反应速率的影响.请在上表空格中填入合理的实验数据.
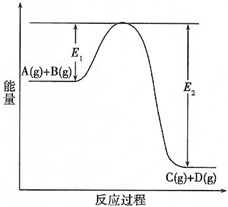
(3)从实验数据分析,实验Ⅰ和Ⅳ研究催化剂对反应的影响.
(4)在反应体系中加入催化剂,E1和E2的变化是:E1减小,E2减小(填“增大”、“减小”或“不变”,下同),反应速率增大,活化能减小,反应热不变.
| 实验编号 | 0.01mol•L-1 酸性KMnO4溶液 | 0.1mol•L-1 H2C2O4溶液 | 水 | 1mol•L-1 MnSO4溶液 | 反应温度 /℃ | 反应时间 |
| Ⅰ | 2mL | 2mL | 0mL | 0 | 20 | 125 |
| Ⅱ | 2mL | 1mL | 1mL | 0 | 20 | 320 |
| Ⅲ | 2mL | 2mL | 0mL | 0 | 50 | 30 |
| Ⅳ | 2mL | 2mL | 0mL | 2滴 | 20 | 10 |
(1)实验记时方法是从溶液混合开始记时,至溶液紫红色刚好褪去时记时结束.
(2)实验Ⅰ和Ⅱ研究浓度对反应速率的影响,实验Ⅰ和Ⅲ研究温度对反应速率的影响.请在上表空格中填入合理的实验数据.
(3)从实验数据分析,实验Ⅰ和Ⅳ研究催化剂对反应的影响.
(4)在反应体系中加入催化剂,E1和E2的变化是:E1减小,E2减小(填“增大”、“减小”或“不变”,下同),反应速率增大,活化能减小,反应热不变.

1.下列物质变化时,不需要破坏化学键的是( )
| A. | HCl溶于水 | B. | 烧碱熔化 | C. | H2燃烧 | D. | I2升华 |
2.某陨石中含有镁元素的一种同位素${\;}_{12}^{28}$Mg,下列对该同位素描述正确的是( )
| A. | 质量数为12 | B. | 核电荷数为12 | ||
| C. | 电子数为28 | D. | 中子数与质子数之差为16 |
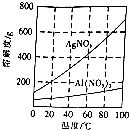 实验室中利用含银废料(主要含有AgNO3和AgCl)制取硝酸银的实验步骤如下:
实验室中利用含银废料(主要含有AgNO3和AgCl)制取硝酸银的实验步骤如下: