题目内容
已知X、Y、Z都是短周期的元素,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相同,而Z原子的最外层电子数是次外层电子数的三倍,Y和Z可以形成两种以上气态化合物,则:
(1)Y的原子结构示意图是 、Z在周期表中的位置是 .
(2)X、Y、Z原子半径由大到小的顺序为 (用元素符号表示).
(3)由Y和Z组成,且Y和Z质量比为7:20的化合物的化学式(分子式)是 .
(4)由X、Y、Z中的两种元素组成,且与X2Z分子具有相同电子数的两种离子是 和 .
(5)X、Y、Z可以形成一种盐,此盐中X、Y、Z元素的原子的个数比为4:2:3,该盐的化学式(分子式)是 .
(1)Y的原子结构示意图是
(2)X、Y、Z原子半径由大到小的顺序为
(3)由Y和Z组成,且Y和Z质量比为7:20的化合物的化学式(分子式)是
(4)由X、Y、Z中的两种元素组成,且与X2Z分子具有相同电子数的两种离子是
(5)X、Y、Z可以形成一种盐,此盐中X、Y、Z元素的原子的个数比为4:2:3,该盐的化学式(分子式)是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X、Y、Z都是短周期的元素知,这三种元素的原子序数小于等于18;
X原子的电子层数与它的核外电子总数相同,X为H元素;
Z原子的最外层电子数是次外层的三倍,Z只能含有2个电子层,最外层为6个电子,则Z为O元素;
X、Y、Z都是短周期的元素,它们的原子序数依次递增,Y和Z可以形成两种以上气态化合物,则Y为N元素.
X原子的电子层数与它的核外电子总数相同,X为H元素;
Z原子的最外层电子数是次外层的三倍,Z只能含有2个电子层,最外层为6个电子,则Z为O元素;
X、Y、Z都是短周期的元素,它们的原子序数依次递增,Y和Z可以形成两种以上气态化合物,则Y为N元素.
解答:
解:根据X、Y、Z都是短周期的元素,得这三种元素的原子序数小于等于18;X原子的电子层数与它的核外电子总数相同,每个电子层上最多排2n2个电子,如果电子层数是1,核外电子数是1,符合题意,如果电子层数是2,核外电子数是2,不符和核外电子排布规律,应舍去;如果电子层数是3,核外电子数是3,不符合核外电子排布规律,舍去;所以X是H元素.
由Z原子的最外层电子数是次外层的三倍,如果次外层的电子数是2,最外层6个电子,符合核外电子排布规律;如果次外层是8个电子,最外层是24个电子,不符合核外电子排布规律,应舍去,所以Z是O元素.
由X、Y、Z都是短周期的元素,它们的原子序数依次递增,Y和Z可以形成两种以上气态化合物,知Y是N元素.
所以:X、Y、Z分别是H、N、O,
(1)根据分析可知,Y为N元素,氮原子的核外电子层数为2、最外层含有5个电子,其原子结构示意图为: ;
;
Z为O元素,核外电子层数为3、最外层含有6个电子,则O元素位于周期表中第二周期ⅥA主族,
故答案为: ;第二周期ⅥA主族;
;第二周期ⅥA主族;
(2)X、Y、Z分别是H、N、O,电子层越多,原子半径越大,电子层相同时核电荷数越大,原子半径越小,则三种原子的半径大小为:N>O>H,
故答案为:N>O>H;
(3)Y和Z的质量比为7:20,其原子个数比为
:
=2:5,O元素的电负性大于N元素的电负性,该化学式氮元素在左边,氧元素在右边,该化合物的化学式为:N2O5,
故答案为:N2O5;
(4)X2Z的化学式为:H2O,该分子有10个电子,由X、Y、Z中的两种元素组成,有10个电子的离子有:OH-和NH4+,
故答案为:OH-;NH4+;
(5)X、Y、Z可以形成一种盐,且这三种元素都是非金属元素,所以阳离子只能是NH4+,此盐中X、Y、Z元素的原子的个数比为4:2:3,所以酸根是NO3-,所以该盐的化学式是NH4NO3,
故答案为:NH4NO3.
由Z原子的最外层电子数是次外层的三倍,如果次外层的电子数是2,最外层6个电子,符合核外电子排布规律;如果次外层是8个电子,最外层是24个电子,不符合核外电子排布规律,应舍去,所以Z是O元素.
由X、Y、Z都是短周期的元素,它们的原子序数依次递增,Y和Z可以形成两种以上气态化合物,知Y是N元素.
所以:X、Y、Z分别是H、N、O,
(1)根据分析可知,Y为N元素,氮原子的核外电子层数为2、最外层含有5个电子,其原子结构示意图为:
 ;
;Z为O元素,核外电子层数为3、最外层含有6个电子,则O元素位于周期表中第二周期ⅥA主族,
故答案为:
 ;第二周期ⅥA主族;
;第二周期ⅥA主族;(2)X、Y、Z分别是H、N、O,电子层越多,原子半径越大,电子层相同时核电荷数越大,原子半径越小,则三种原子的半径大小为:N>O>H,
故答案为:N>O>H;
(3)Y和Z的质量比为7:20,其原子个数比为
| 7 |
| 14 |
| 20 |
| 16 |
故答案为:N2O5;
(4)X2Z的化学式为:H2O,该分子有10个电子,由X、Y、Z中的两种元素组成,有10个电子的离子有:OH-和NH4+,
故答案为:OH-;NH4+;
(5)X、Y、Z可以形成一种盐,且这三种元素都是非金属元素,所以阳离子只能是NH4+,此盐中X、Y、Z元素的原子的个数比为4:2:3,所以酸根是NO3-,所以该盐的化学式是NH4NO3,
故答案为:NH4NO3.
点评:本题考查了位置结构与性质的关系,题目难度中等,此类型题的解题规律是:先根据题干信息推断元素,再根据元素化合物知识解决有关问题,试题有利于培养学生灵活应用所学知识的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列实验方案中,不能测定NaCl和NaHCO3混合物中NaHCO3质量分数的是( )
| A、取a克混合物充分加热,减重b克 |
| B、取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克 |
| C、取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体 |
| D、取a 克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得 b 克固体 |
 乙酸橙花酯是一种食用香料,结构如图所示.下列关于该物质的说法有:
乙酸橙花酯是一种食用香料,结构如图所示.下列关于该物质的说法有:①该化合物属于酯类;②分子式C11H18O2;③1mol该化合物最多可与2mol H2反应;④化合物能发生的反应类型有:加成、取代、氧化、加聚;⑤该化合物有一种同分异构体属于酚类.其中正确的是( )
| A、①③④ | B、②③⑤ |
| C、①④⑤ | D、①③⑤ |
关于下列各装置图的叙述中,不正确的是( )
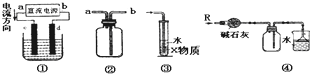

| A、装置①中,c为阳极,d为阴极 |
| B、装置②可用于收集H2、NH3、Cl2、HCl、NO2等 |
| C、装置③中X为苯,可用于吸收氨气或氯化氢 |
| D、装置④可用于干燥、收集氨气,并吸收多余的氨气 |
已知在Ca3(PO4)2的饱和溶液中,c(Ca2+)=2.O×10-6 mol?L-l,c(PO43-)=1.58×10-6mol?L-l,则Ca3(PO4)2的Ksp为( )
| A、2.0×10-29 |
| B、3.2×l0-12 |
| C、6.3×10-18 |
| D、5.1×10-27 |
 所示(其中虚线框内为未知部分的结构),A可发生如下转化(其中部分产物已略去).
所示(其中虚线框内为未知部分的结构),A可发生如下转化(其中部分产物已略去).
