题目内容
14.下列说法正确的是②⑥⑨⑩.①周期表中有7个横行就有7个周期,有16个纵行就有16个族;②非金属元素(不包括稀有气体元素)全是主族元素;③周期表中第三纵行至第十纵行全是副族元素;④稀有气体元素原子最外层都是8电子稳定结构;⑤第IA族元素都是碱金属元素;⑥副族元素全是金属元素;⑦短周期元素就是指前20号元素;⑧周期表中每周期元素都是从第IA族开始,至第VⅡA族结束;⑨一种核素就是一种原子,也是一种元素;⑩互称同位素的原子一定是同种元素,肯定不是同种核素.
分析 ①周期表中有7个横行就有7个周期,有18个纵行,有16个族;
②非金属元素(不包括稀有气体元素)全是主族元素;
③周期表中第三纵行至第十纵行包括部分副族、Ⅷ族元素;
④He原子只有2个电子;
⑤第IA族元素包括氢元素、碱金属元素;
⑥副族元素全是金属元素;
⑦短周期元素是第一、二、三周期元素;
⑧周期表中每周期元素都是从第IA族开始,至零族结束;
⑨一种核素就是一种原子,也是一种元素;
⑩互称同位素的原子质子数相同,一定是同种元素,肯定不是同种核素.
解答 解:①周期表中有7个横行就有7个周期,有18个纵行,有7个主族、7个副族、1个零族、1个第Ⅷ族,共有有16个族,故错误;
②非金属元素(不包括稀有气体元素)全是主族元素,故正确;
③周期表中第3-7列分别为ⅢB-ⅦB族,而8、9、10三列为第Ⅷ族,故错误;
④He原子只有2个电子,最外层不满足8电子结构,故错误;
⑤第IA族元素除碱金属元素外,还包括氢元素,故错误;
⑥副族元素全是金属元素,故正确;
⑦短周期元素是第一、二、三周期元素,而19、20号元素为第四周期元素,故错误;
⑧周期表中每周期元素都是从第IA族开始,至零族结束,故错误;
⑨一种核素就是一种原子,也是一种元素,故正确;
⑩互称同位素的原子质子数相同,一定是同种元素,中子数不同,肯定不是同种核素,故正确,
故答案为:②⑥⑨⑩.
点评 本题考查元素周期表、同位素、核素、元素等,比较基础,注意对基础知识的掌握.

练习册系列答案
相关题目
4.下列有关实验操作说法中,不正确的是( )
| A. | 向25mL沸水中滴加5-6滴稀的FeCl3溶液制备氢氧化铁胶体 | |
| B. | 用量筒、试管、胶头滴管、玻璃棒、蒸馏水和 pH试纸,可鉴别pH 相等的硫酸和醋酸 | |
| C. | 用FeSO4、NaOH和盐酸等试剂在空气中可以制备纯净的FeCl3溶液 | |
| D. | 用NaOH溶液和盐酸可除去MgCl2溶液中混有的AlCl3 |
5.已知某无色溶液中含有Na+,还可能大量存在Ag+、H+、CO32-、Cl-.取出少量原溶液并滴入盐酸会产生气体,但是不会产生白色沉淀.则溶液中( )
| A. | 一定不存在Ag+和NO3- | B. | 一定存在CO32- | ||
| C. | 一定存在NO3-和Cl- | D. | 一定不存在NO3-、H+ |
9.下列设计的实验方案能达到实验目的是( )
| A. | 向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体 | |
| B. | 取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液一定含有Fe2+ | |
| C. | 检验溶液中是否含有Fe3+:取少量待检验溶液,向其中加入少量新制氯水,再滴加KSCN溶液,观察实验现象 | |
| D. | 探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2mL 5%H2O2和1mL H2O,向另一支试管中加入2mL 5%H2O2和1mL FeCl3溶液,观察并比较实验现象 |
6.相同条件下,通过相同的电量分别电解CuCl2和AgNO3溶液,若析出64g Cu,则析出Ag的质量是( )
| A. | 108g | B. | 54g | C. | 216g | D. | 64g |
10.以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工.
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ
•mol-1
①该反应在常温下不能自发进行(填“能”与“不能”);
②一定温度和压强下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是bd(填字母,下同)
a.容器中的压强不变
b.1mol H-H键断裂的同时断裂2mol H-O
c.c(CO)=c(H2)
d.密闭容器的容积不再改变
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如表三组数据:
①该反应为放(填“吸”或“放”)热反应;
②若实验3达平衡时与实验2平衡状态中各物质的质量分数分别相等,且t<3min,则a、b应满足的关系是a=2b且b>1(用含a、b的数学式表示)
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ
•mol-1
①该反应在常温下不能自发进行(填“能”与“不能”);
②一定温度和压强下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是bd(填字母,下同)
a.容器中的压强不变
b.1mol H-H键断裂的同时断裂2mol H-O
c.c(CO)=c(H2)
d.密闭容器的容积不再改变
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如表三组数据:
| 实验组 | 温度 ℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②若实验3达平衡时与实验2平衡状态中各物质的质量分数分别相等,且t<3min,则a、b应满足的关系是a=2b且b>1(用含a、b的数学式表示)
11.列关于化学键的说法正确的是( )
| A. | C、N、O、H四种元素形成的化合物一定既有离子键,又有共价键 | |
| B. | 不同元素的原子构成的分子不一定只含极性共价键 | |
| C. | 含极性键的共价化合物一定是电解质 | |
| D. | HF的分子间作用力大于HCl,故HF比HCl更稳定 |
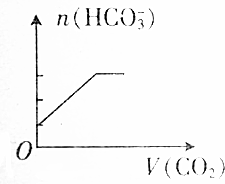
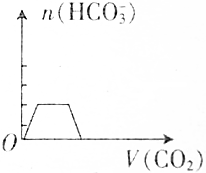
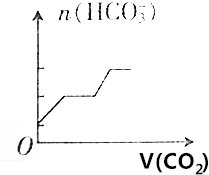
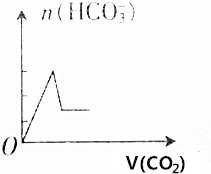
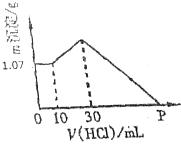 把NaOH、AlCl3、FeCl3三种固体组成的混合物熔于足量水中后,有1.07g沉淀,在所得溶液中逐滴加入0.5mol/L盐酸,加入盐酸体积与生成沉淀的质量关系如图所示,试求
把NaOH、AlCl3、FeCl3三种固体组成的混合物熔于足量水中后,有1.07g沉淀,在所得溶液中逐滴加入0.5mol/L盐酸,加入盐酸体积与生成沉淀的质量关系如图所示,试求