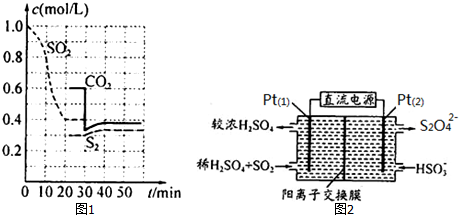
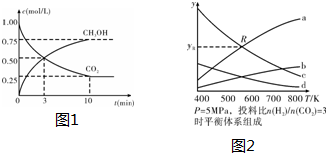
题目内容
2.将足量的二氧化碳通入含有等物质的量的碳酸钠和碳酸氢钠的混合溶液中,碳酸氢根离子的物质的量(n)与二氧化碳的体积(V)之间的关系正确的是( )| A. | 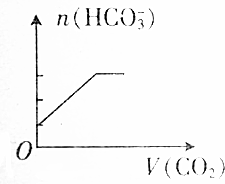 | B. | 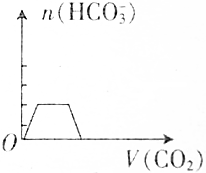 | ||
| C. | 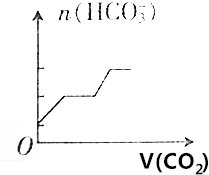 | D. | 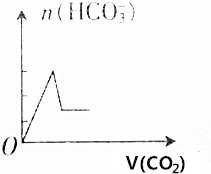 |
分析 碳酸钠与二氧化碳的反应为:Na2CO3+CO2=2NaHCO3,将足量的二氧化碳通入含有等物质的量的碳酸钠和碳酸氢钠的混合溶液中,开始时已经含有碳酸氢根离子,则图象B、D错误;设碳酸钠和碳酸氢钠的物质的量都是1mol,1mol碳酸钠完全反应转化成2mol碳酸氢钠,则最终碳酸氢根离子的物质的量为3mol,据此进行判断.
解答 解:将足量的二氧化碳通入含有等物质的量的碳酸钠和碳酸氢钠的混合溶液中,发生反应为Na2CO3+CO2=2NaHCO3,
设碳酸钠和碳酸氢钠的物质的量都是1mol,
1mol碳酸钠与二氧化碳完全反应生成2mol碳酸氢根离子,
则反应后碳酸氢根离子的总物质的量为3mol,
由于通入二氧化碳气体前已经存在碳酸氢根离子,则图象B、D错误;
通入二氧化碳气体前的碳酸氢根离子的物质的量与反应后溶液中碳酸氢根离子的物质的量之比为1:3,满足该条件的图象为A,
故选A.
点评 本题考查了离子反应的计算与判断,题目难度中等,明确发生反应的实质为解答关键,解答时可通过排除法舍弃CD,然后根据最初与最终溶液中碳酸氢根离子的物质的量关系得出正确答案.

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案
相关题目
17.在常溫下,将pH=11的某碱溶液和pH=3的某酸溶液等体积混合后,下列说法不正确的是( )
| A. | 若所得溶液呈中性,则生成的盐可能为强酸强碱盐 | |
| B. | 若所得溶液呈碱性,则一定是强碱与弱酸溶液反应 | |
| C. | 若所得溶液呈酸性,则可能是弱酸与强碱溶液反应 | |
| D. | 若所得溶液的pH=9,则水电离产生的c(OH-)可能为10-9mol/L |
11.下列物质中,不能溶于冷的浓H2SO4中的是( )
| A. | 溴乙烷 | B. | 乙醚 | C. | 乙醇 | D. | 乙烯 |