题目内容
5.已知:①1mol H2分子中化学键断裂时需要吸收436kJ的能量;②1mol Cl2分子中化学键断裂时需要吸收243kJ的能量;③由H原子和Cl原子形成1mol HCl分子时释放431kJ的能量.下列叙述中正确的是( )| A. | 氢气和氯气反应生成氯化氢气体是放热反应,所以不需要条件就能自发进行 | |
| B. | 氢气和氯气反应生成2 mol氯化氢气体,反应吸收183 kJ的热量 | |
| C. | 氢气和氯气反应生成2 mol氯化氢气体,反应放出183 kJ的热量 | |
| D. | 氢气和氯气反应生成1 mol氯化氢气体,反应放出183 kJ的热量 |
分析 A.反应吸热还是放热与条件无关;
B.根据反应热等于反应物的总键能-生成物的总键能来解答;
C.根据反应热等于反应物的总键能-生成物的总键能来解答;
D.反应中的热量与反应物的物质的量成正比.
解答 解:H2(g)+Cl2(g)=2HCl(g)的反应热=反应物的总键能-生成物的总键能=436kJ•mol-1+243kJ•mol-1-2×431 kJ•mol-1=-183kJ•mol-1,故1mol氢气与1mol氯气反应生成2 mol氯化氢气体时放出热量为183KJ,
A.反应吸热还是放热与条件无关,例如铝热反应在高温下才能进行但是为放热反应,而氯化铵和氢氧化钡在常温下就能反应,但是吸热反应,故A错误;
B.H2(g)+Cl2(g)=2HCl(g)的反应热=反应物的总键能-生成物的总键能=436kJ•mol-1+243kJ•mol-1-2×431 kJ•mol-1=-183kJ•mol-1,故1mol氢气与1mol氯气反应生成2 mol氯化氢气体时放出热量为183KJ,故B错误,C正确;
D.当生成1mol氯化氢气体时,放出的热量是原来的一半,应放出热量为91.5KJ,故D错误;
故选C.
点评 本题主要考查了反应热的计算,难度不大,注意掌握反应热等于反应物的总键能-生成物的总键能.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.下列有关试剂的保存方法,错误的是( )
| A. | 浓硝酸保存在棕色玻璃试剂瓶中 | |
| B. | 少量的钠保存在煤油中 | |
| C. | 氢氧化钠溶液保存在带橡皮塞的玻璃试剂瓶中 | |
| D. | FeSO4溶液中加入少量Fe粉和稀盐酸 |
16.下列营养物质在人体内发生的变化及其对人的生命活动所起的作用叙述不正确的是( )
| A. | 淀粉→葡萄糖→CO2和H2O(释放能量维持生命活动) | |
| B. | 纤维素→葡萄糖→CO2和H2O(释放能量维持生命活动) | |
| C. | 油脂→甘油和高级脂肪酸→CO2和H2O(释放能量维持生命活动) | |
| D. | 麦芽糖→葡萄糖→CO2和H2O(释放能量维持生命活动) |
13.图表归纳是学习化学的常用方法,某同学归纳的下表物质与图中对应关系正确的是( )
| 选项 | X | Y | Z |  |
| A | 含氧酸 | 一元强酸 | HclO4 | |
| B | 易溶碱 | 强碱 | NaOH | |
| C | 盐 | 酸式盐 | NaHCO3 | |
| D | 非电解质 | 氧化物 | CO2 |
| A. | A | B. | B | C. | C | D. | D |
20.下列叙述正确的是( )
| A. | 由同种元素组成的物质肯定是纯净物 | |
| B. | 一种元素可形成多种离子 | |
| C. | 含有金属元素的离子一定都是阳离子 | |
| D. | 具有相同质子数的粒子都属于同种元素 |
15.下列说法正确的是( )
| A. | 液态HCl、固态AgCl均不导电,所以HCl、AgCl是非电解质 | |
| B. | NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质 | |
| C. | 蔗糖、酒精在液态或水溶液里均不导电,所以它们是非电解质 | |
| D. | 铜、石墨均导电,所以它们是电解质 |
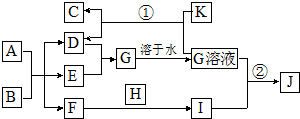 在如图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,K是黑色固体,D和F反应可用于工业上生产漂白液,H可用于制造光导纤维,J是一种乳白色凝胶状沉淀.(部分生成物和反应条件未列出)
在如图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,K是黑色固体,D和F反应可用于工业上生产漂白液,H可用于制造光导纤维,J是一种乳白色凝胶状沉淀.(部分生成物和反应条件未列出)