题目内容
(1)除去NaHCO3溶液中的Na2CO3杂质用 试剂,化学方程式为 .
(2)除去Fe2O3粉末中混入的Al2O3杂质用 试剂,化学方程式为 .
(3)除去NH4Cl粉末中混入的AlCl3杂质用 试剂,离子方程式为 .
(4)除去 CO2气体中混入的HCl气体用 试剂,离子方程式为 .
(2)除去Fe2O3粉末中混入的Al2O3杂质用
(3)除去NH4Cl粉末中混入的AlCl3杂质用
(4)除去 CO2气体中混入的HCl气体用
考点:物质分离、提纯的实验方案设计,钠的重要化合物,镁、铝的重要化合物
专题:几种重要的金属及其化合物
分析:(1)碳酸钠溶液与二氧化碳反应生成生成碳酸氢钠;
(2)Al2O3可与氢氧化钠溶液反应而除去;
(3)可加入氨水除杂;
(4)可用饱和碳酸氢钠溶液除杂.
(2)Al2O3可与氢氧化钠溶液反应而除去;
(3)可加入氨水除杂;
(4)可用饱和碳酸氢钠溶液除杂.
解答:
解:(1)碳酸钠溶液与二氧化碳反应生成生成碳酸氢钠,则通二氧化碳可除杂,化学反应为Na2CO3+H2O+CO2=2NaHCO3,
故答案为:CO2;Na2CO3+H2O+CO2=2NaHCO3;
(2)氧化铝为两性氧化物,可与强碱反应,反应的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O,故答案为:NaOH;Al2O3+2NaOH=2NaAlO2+H2O;
(3)可加入氨水除杂,反应的离子方程式为Al3++3NH3?H2O═Al(OH)3↓+3NH4+,故答案为:氨水;Al3++3NH3?H2O═Al(OH)3↓+3NH4+;
(4)可用饱和碳酸氢钠溶液除杂,离子方程式为HCO3-+H+=CO2↑+H2O,故答案为:饱和碳酸氢钠溶液;HCO3-+H+=CO2↑+H2O.
故答案为:CO2;Na2CO3+H2O+CO2=2NaHCO3;
(2)氧化铝为两性氧化物,可与强碱反应,反应的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O,故答案为:NaOH;Al2O3+2NaOH=2NaAlO2+H2O;
(3)可加入氨水除杂,反应的离子方程式为Al3++3NH3?H2O═Al(OH)3↓+3NH4+,故答案为:氨水;Al3++3NH3?H2O═Al(OH)3↓+3NH4+;
(4)可用饱和碳酸氢钠溶液除杂,离子方程式为HCO3-+H+=CO2↑+H2O,故答案为:饱和碳酸氢钠溶液;HCO3-+H+=CO2↑+H2O.
点评:本题考查除杂及离子反应方程式的书写,为高考常见题型,注意除杂的原则及物质的性质即可解答,侧重氧化还原反应的考查,题目难度不大.

练习册系列答案
相关题目
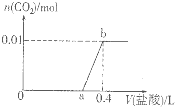 向NaOH和Na2CO3混合溶液中滴加0.1molgL-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示.下列判断正确的是( )
向NaOH和Na2CO3混合溶液中滴加0.1molgL-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示.下列判断正确的是( )| A、在0-a范围内,只发生中和反应 |
| B、ab段发生反应的离子方程式为:CO32-+2H+=CO2↑+H2O |
| C、a=0.2 |
| D、原混合溶液中NaOH与Na2CO3的物质的量之比为2:1 |
a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg五种金属中的一种.已知由此判断a、b、c、d、e依次为( )
(1)a、c均能与稀硫酸反应放出气体
(2)b与d的硝酸盐反应,置换出单质d
(3)c与强碱反应放出气体,e的一种氧化物具有磁性.
(1)a、c均能与稀硫酸反应放出气体
(2)b与d的硝酸盐反应,置换出单质d
(3)c与强碱反应放出气体,e的一种氧化物具有磁性.
| A、Fe、Cu、Al、Ag、Mg |
| B、Mg、Cu、Al、Ag、Fe |
| C、Al、Cu、Mg、Ag、Fe |
| D、Mg、Ag、Al、Cu、Fe |
在醋酸中存在电离平衡:CH3COOH?CH3COO-+H+,△H>0要使溶液中的c(CH3COO-)提高,并且使电离平衡逆向移动,应采取的措施是( )
| A、加水 |
| B、加热 |
| C、加CH3COONa固体 |
| D、加很稀的NaOH溶液 |
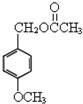 乙酸茴香酯具有花香和茴香香气,可作为配制食用香精的原料,其结构简式如图:
乙酸茴香酯具有花香和茴香香气,可作为配制食用香精的原料,其结构简式如图: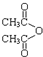 )反应制得.写出反应的化学方程式:
)反应制得.写出反应的化学方程式: