题目内容
元素周期表和元素周期律可以指导人们进行规律性的推测和判断.下列说法不合理的是( )
| A、若X+和Y2-的核外电子层结构相同,则原子序数:X>Y |
| B、Cs和Ba分别位于第六周期ⅠA和ⅡA族,碱性:CsOH>Ba(OH)2 |
| C、硅、锗都位于金属与非金属的交界处,都可以做半导体材料 |
| D、由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S |
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:A.X+和Y2-的核外电子层结构相同,阳离子原子序数较大;
B.同周期元素从左到右,元素的金属性逐渐减弱,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强;
C.在金属和非金属性元素的交界处的单质能作半导体材料;
D.元素的非金属与元素最高价氧化物对应水化物的酸性强弱有关,与氢化物水溶液的酸性无关.
B.同周期元素从左到右,元素的金属性逐渐减弱,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强;
C.在金属和非金属性元素的交界处的单质能作半导体材料;
D.元素的非金属与元素最高价氧化物对应水化物的酸性强弱有关,与氢化物水溶液的酸性无关.
解答:
解:A.阳离子原子序数=核外电子数+电荷数,阴离子原子序数=核外电子数-电荷数,所以若X+和Y2-的核外电子层结构相同,则原子序数:X>Y,故A正确;
B.同周期元素自左而右金属性减弱,金属性Cs>Ba,金属性越强最高价氧化物对应水化物的碱性越强,故碱性CsOH>Ba(OH)2,故B正确;
C.在金属和非金属性元素的交界处的单质能作半导体材料,硅、锗都位于金属与非金属的交界处,都可以做半导体材料,故C正确;
D.元素的非金属与元素最高价氧化物对应水化物的酸性强弱有关,与氢化物水溶液的酸性无关,如酸性HCl>HF,但非金属性Cl<F,故D错误.
故选D.
B.同周期元素自左而右金属性减弱,金属性Cs>Ba,金属性越强最高价氧化物对应水化物的碱性越强,故碱性CsOH>Ba(OH)2,故B正确;
C.在金属和非金属性元素的交界处的单质能作半导体材料,硅、锗都位于金属与非金属的交界处,都可以做半导体材料,故C正确;
D.元素的非金属与元素最高价氧化物对应水化物的酸性强弱有关,与氢化物水溶液的酸性无关,如酸性HCl>HF,但非金属性Cl<F,故D错误.
故选D.
点评:本题涉及元素周期律中非金属性和金属性强弱的判断、原子序数的判断等知识点,根据元素在周期表中的位置结合元素周期律来解答,熟记元素周期律内容,题目难度不大.

练习册系列答案
 综合自测系列答案
综合自测系列答案
相关题目
五种短周期的原子半径及主要化合价如表,下列叙述不正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.104 | 0.111 | 0.066 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A、L、T形成的化合物的晶体类型与M、T形成的化合物的晶体类型相同 |
| B、工业生产中L、M的单质均用电解其熔融盐的方法冶炼而得 |
| C、相同条件下,等物质的量的单质与氢气化合放出能量:T>Q |
| D、离子半径:Q2->T2->L2+>M3+ |
下列说法正确的是( )
| A、20mL1 mol/L Al2(SO4)3溶液中,Al3+和SO42-离子总数为6.02×1023 |
| B、标准状况下,22.4L Cl2和HCl的混合气体中含分子总数为2×6.02×1023 |
| C、0.1 mol8135Br原子中含中子数为3.5×6.02×1023 |
| D、30g甲醛中含共用电子对总数为4×6.02×1023 |
将质量分数为a%的NaOH溶液蒸发掉bg水后,变成cmL 2a%的NaOH不饱和溶液,则蒸发后所得溶液中NaOH的物质的量浓度是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
乙酸橙花酯是一种食用香料,其结构为 下列关于该物质的说法正确的是( )
下列关于该物质的说法正确的是( )
 下列关于该物质的说法正确的是( )
下列关于该物质的说法正确的是( )| A、分子式是C11H18O2 |
| B、1 mol乙酸橙花酯跟H2反应,最多消耗2 mol H2 |
| C、1 mol乙酸橙花酯跟NaOH溶液反应,最多消耗2 mol NaOH |
| D、乙酸橙花酯的一种同分异构体可能是酚类 |
双球连通管中发生2NO2?N2O4+Q(Q>0).若同时向两烧杯中分别加入等温、等体积的蒸馏水(左)和0.1mol/L H2O2溶液(右),再向右侧烧杯中加入少量Fe2(SO4)3固体后,则下列有关推断中正确的是( )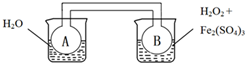

| A、实验时,A、B中的压强始终相等 |
| B、若右侧烧杯发生吸热反应,则A中更快达到平衡 |
| C、若右侧烧杯发生放热反应,则A中颜色较深 |
| D、能用该装置推断右侧烧杯中反应的热效应 |
 下表列出了断裂某些化学键所需的能量:
下表列出了断裂某些化学键所需的能量: 结构)共有
结构)共有