题目内容
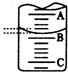
某化学小组模拟“侯氏制碱法”,以NaCl、NH3、CO2和水等为原料以及如图所示装置制取NaHCO3,反应的化学方程式为NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl.然后再将NaHCO3制成Na2CO3.

(1)装置乙的作用是 .为防止污染空气,尾气中含有的 需要进行吸收处理.
(2)由装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有 、 、 .NaHCO3转化为Na2CO3的化学方程式为 .

(1)装置乙的作用是
(2)由装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有
考点:纯碱工业(侯氏制碱法)
专题:实验题
分析:(1)装置甲是制备二氧化碳,气体中含有氯化氢气体对后续实验产生干扰,需要除去;尾气中含有氨气,不能排到空气中,需要吸收;
(2)装置丙中是氨化的饱和食盐水中通入二氧化碳生成碳酸氢钠晶体,通过过滤得到晶体洗涤灼烧得到碳酸钠;NaHCO3转化为Na2CO3的方法是固体加热分解.
(2)装置丙中是氨化的饱和食盐水中通入二氧化碳生成碳酸氢钠晶体,通过过滤得到晶体洗涤灼烧得到碳酸钠;NaHCO3转化为Na2CO3的方法是固体加热分解.
解答:
解:(1)装置甲是制备二氧化碳气体的反应装置,生成的二氧化碳气体中含有氯化氢气体,对制备碳酸氢钠有影响,装置乙的作用是吸收氯化氢气体;最后的尾气中含有氨气不能排放到空气中,需要进行尾气吸收;
故答案为:除去二氧化碳中的氯化氢气体;氨气;
(2)由装置丙中产生的NaHCO3发生的反应为,NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl;制取Na2CO3时需要过滤得到晶体,洗涤后加热灼烧得到碳酸钠;碳酸氢钠受热分解生成二氧化碳、碳酸钠、水,反应为:2NaHCO3
Na2CO3+H2O+CO2↑,
故答案为:过滤、洗涤、灼烧; 2NaHCO3
Na2CO3+H2O+CO2↑.
故答案为:除去二氧化碳中的氯化氢气体;氨气;
(2)由装置丙中产生的NaHCO3发生的反应为,NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl;制取Na2CO3时需要过滤得到晶体,洗涤后加热灼烧得到碳酸钠;碳酸氢钠受热分解生成二氧化碳、碳酸钠、水,反应为:2NaHCO3
| ||
故答案为:过滤、洗涤、灼烧; 2NaHCO3
| ||
点评:本题考查了 工业制纯碱的原理分析,生产过程中的物质变化,混合物成分的分析判断应用,题目难度中等.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
化学式与俗名相符的是( )
| A、烧碱Na2CO3 |
| B、胆矾CuSO4?5H2O |
| C、苏打NaHCO3 |
| D、纯碱NaOH |
科学家发现了如下反应:O2+PtF6═O2(PtF6),已知O2(PtF6)为离子化合物,Pt为+5价,下列说法正确的是( )
| A、O和F无正化合价 |
| B、1mol O2参加反应,转移1mol e- |
| C、上述反应中O2作氧化剂 |
| D、上述反应属于加成反应 |
 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,在实验室用标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,在实验室用标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:


 经两步反应制得,写出第一步反应的化学方程式
经两步反应制得,写出第一步反应的化学方程式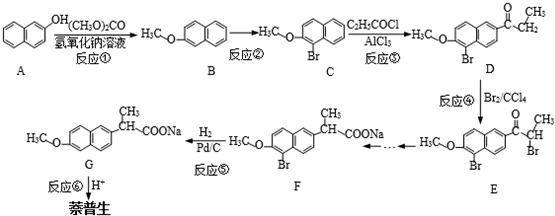
 )的化学性质与苯相似.
)的化学性质与苯相似.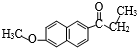 )外,最有可能生成的副产物(与H互为同分异构体)的结构简式是
)外,最有可能生成的副产物(与H互为同分异构体)的结构简式是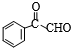 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).