题目内容
A、B、C、D为原子序数依次增大的四种短周期元素,其性质或结构信息如下表:
试回答以下问题
(1)B在周期表中的位置是 ,B的氢化物与E的氢化物比较,沸点较高的是 (填化学式).
(2)D3B可与水反应生成2种碱性物质,请写出这一化学方程式 .
(3)写出丙的电子式为 .并说明丙在空气中漂白的原理(用化学方程式表示) .(请参考下表数据)
(4)由A、B、C、D四种元素中的三种元素组成的一种盐丁,其外观与氯化钠相似,丁
的水溶液呈碱性.将光亮的铜丝插入丁溶液中,没有现象发生,如用盐酸酸化,反应迅速发生,铜丝缓慢溶解生成深绿色溶液,写出该反应的离子方程式 .
| 元素 | A | B | C | D | E |
| 性质 或结 构信 息 | 室温下单质呈气态,原子最外层电子数与D相同 | D3B中阳离子与阴离子的电子层结构相同 | A和C可形成两种常见的化合物甲和乙,乙具有弱酸性 | 单质质软、银白色固体、导电性强,在空气中燃烧生成淡黄色固体 | E的气态氢化物和最高价氧化物对应的水化物均为强酸,C、D和E三种元素形成的一种盐丙为某消毒液的主要成分 |
(1)B在周期表中的位置是
(2)D3B可与水反应生成2种碱性物质,请写出这一化学方程式
(3)写出丙的电子式为
| 酸 | 电离常数 |
| HClO | Ka=3.0×10-8 |
| H2CO3 | Ka1=4.3×10-7,Ka2=5.6×10-11 |
的水溶液呈碱性.将光亮的铜丝插入丁溶液中,没有现象发生,如用盐酸酸化,反应迅速发生,铜丝缓慢溶解生成深绿色溶液,写出该反应的离子方程式
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D为原子序数依次增大的四种短周期元素,
D单质质软,银白色固体,导电性强,在空气中燃烧生成淡黄色固体,则D是Na元素;
A室温下单质呈气态,原子最外层电子数与D相同,则A是H元素;
D3B中阳离子与阴离子的电子层结构相同,B显-3价,且阴阳离子电子层结构相同,所以B是N元素;
A和C可形成两种常见的化合物甲和乙,乙具有弱酸性,C的原子序数大于B小于C,所以C是O元素,乙是双氧水;
E的气态氢化物和最高价氧化物对应的水化物均为强酸,故E是氯;C、D和E三种元素形成的一种盐丙为某消毒液的主要成分,故丙为次氯酸钠,据此解答各小题即可.
D单质质软,银白色固体,导电性强,在空气中燃烧生成淡黄色固体,则D是Na元素;
A室温下单质呈气态,原子最外层电子数与D相同,则A是H元素;
D3B中阳离子与阴离子的电子层结构相同,B显-3价,且阴阳离子电子层结构相同,所以B是N元素;
A和C可形成两种常见的化合物甲和乙,乙具有弱酸性,C的原子序数大于B小于C,所以C是O元素,乙是双氧水;
E的气态氢化物和最高价氧化物对应的水化物均为强酸,故E是氯;C、D和E三种元素形成的一种盐丙为某消毒液的主要成分,故丙为次氯酸钠,据此解答各小题即可.
解答:
解:依据分析可知:A为氢、B为氮、C为氧、D为钠,乙为双氧水,丙为次氯酸钠;
(1)B为N,N原子核外有两个电子层,最外层有5个电子,所以N位于第二周期第VA族,由于N原子容易形成氢键,故氨气的沸点比氯化氢高,
故答案为:第二周期ⅤA族;NH3;
(2)氮化钠和水反应生成氨气和氢氧化钠,是两种碱性物质,符合题意,故反应方程式为:Na3N+3H2O=NH3↑+3NaOH,故答案为:Na3N+3H2O=NH3↑+3NaOH;
(3)丙是NaClO,NaClO是离子化合物,由Na+离子和ClO-离子构成,NaClO的电子式为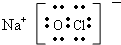 ,次氯酸是弱酸,比碳酸的酸性还弱,但是比碳酸氢根的酸性强,故空气中二氧化碳溶于水形成碳酸,碳酸置换出次氯酸钠中的次氯酸,碳酸变成碳酸氢钠,故次氯酸钠具有漂白性,化学反应方程式为:NaClO+H2O+CO2=NaHCO3+HClO,故答案为:
,次氯酸是弱酸,比碳酸的酸性还弱,但是比碳酸氢根的酸性强,故空气中二氧化碳溶于水形成碳酸,碳酸置换出次氯酸钠中的次氯酸,碳酸变成碳酸氢钠,故次氯酸钠具有漂白性,化学反应方程式为:NaClO+H2O+CO2=NaHCO3+HClO,故答案为: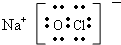 ;NaClO+H2O+CO2=NaHCO3+HClO;
;NaClO+H2O+CO2=NaHCO3+HClO;
(4)酸性条件下,铜被亚硝酸钠氧化生成,同时亚硝酸钠被还原生成一氧化氮,反应方程式为Cu+2NO2-+4H+=Cu2++2NO↑+2H2O,
故答案为:Cu+2NO2-+4H+=Cu2++2NO↑+2H2O.
(1)B为N,N原子核外有两个电子层,最外层有5个电子,所以N位于第二周期第VA族,由于N原子容易形成氢键,故氨气的沸点比氯化氢高,
故答案为:第二周期ⅤA族;NH3;
(2)氮化钠和水反应生成氨气和氢氧化钠,是两种碱性物质,符合题意,故反应方程式为:Na3N+3H2O=NH3↑+3NaOH,故答案为:Na3N+3H2O=NH3↑+3NaOH;
(3)丙是NaClO,NaClO是离子化合物,由Na+离子和ClO-离子构成,NaClO的电子式为
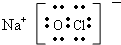 ,次氯酸是弱酸,比碳酸的酸性还弱,但是比碳酸氢根的酸性强,故空气中二氧化碳溶于水形成碳酸,碳酸置换出次氯酸钠中的次氯酸,碳酸变成碳酸氢钠,故次氯酸钠具有漂白性,化学反应方程式为:NaClO+H2O+CO2=NaHCO3+HClO,故答案为:
,次氯酸是弱酸,比碳酸的酸性还弱,但是比碳酸氢根的酸性强,故空气中二氧化碳溶于水形成碳酸,碳酸置换出次氯酸钠中的次氯酸,碳酸变成碳酸氢钠,故次氯酸钠具有漂白性,化学反应方程式为:NaClO+H2O+CO2=NaHCO3+HClO,故答案为: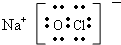 ;NaClO+H2O+CO2=NaHCO3+HClO;
;NaClO+H2O+CO2=NaHCO3+HClO;(4)酸性条件下,铜被亚硝酸钠氧化生成,同时亚硝酸钠被还原生成一氧化氮,反应方程式为Cu+2NO2-+4H+=Cu2++2NO↑+2H2O,
故答案为:Cu+2NO2-+4H+=Cu2++2NO↑+2H2O.
点评:本题考查元素化合物性质,正确推断元素是解本题关键,利用物质的性质来分析解答即可,难度中等.

练习册系列答案
相关题目
卫生部发出公告,自2011年5月1日起,禁止在面粉生产中添加过氧化钙(CaO2)等食品添加剂.下列对于过氧化钙(CaO2)的叙述错误的是( )
| A、CaO2具有氧化性,对面粉可能具有增白作用 |
| B、CaO2和CO2反应的化学方程式为:2CaO2+2CO2=2CaCO3+O2 |
| C、CaO2和水反应时,每产生1 mol O2转移电子4 mol |
| D、CaO2中阴阳离子的个数比为1:1 |
下列叙述中不正确的是( )
| A、向含有少量CaCO3沉淀的水中通入CO2,沉淀溶解;再向溶液中加入Na2CO3溶液,又有CaCO3沉淀生成 |
| B、向Na2CO3溶液中逐滴加入含等物质的量HCl的稀盐酸,生成的CO2与原Na2CO3的物质的量之比为1:2 |
| C、等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下,NaHCO3生成的CO2较多 |
| D、向Na2CO3饱和溶液中通入CO2,有NaHCO3结晶析出 |
下列离子方程式错误的是( )
| A、氯化铝溶液中加入过量氨水:Al3++3NH3?H2O═Al(OH)3↓+3NH4+ |
| B、烧碱溶液中滴入少量同物质的量浓度的氯化铝溶液 Al3++4OH-═AlO2-+2H2O |
| C、向碳酸钠溶液中滴加少量的稀硫酸:CO32-+2H+═CO2↑+H2O |
| D、氢氧化铁溶于盐酸:Fe(OH)3+3H+═Fe3++3H2O |
 A、B、C、D都是中学化学中的常见化合物,均由周期表前18号元素组成,D为红综色气体,甲、乙则是两种单质,以上单质和化合物之间有如图所示的反应关系(反应物和生成物均无省略),反应①②均是工业生产中的重要反应.
A、B、C、D都是中学化学中的常见化合物,均由周期表前18号元素组成,D为红综色气体,甲、乙则是两种单质,以上单质和化合物之间有如图所示的反应关系(反应物和生成物均无省略),反应①②均是工业生产中的重要反应. 有A、B、C、D、E、F、G七种前四周期元素,原子序数依次增大,其相关信息如表:
有A、B、C、D、E、F、G七种前四周期元素,原子序数依次增大,其相关信息如表: