题目内容
17.将两个铂电极插入KOH溶液中,向两极分别通入CH4和O2,即可构成CH4燃料电池.已知通入O2一极的电极反应式是:O2+2H2O+4e-═4OH-.下列有关叙述中,不正确的是( )| A. | 通入CH4的电极为负极 | B. | 正极发生氧化反应 | ||
| C. | 溶液中的OH-向负极移动 | D. | 工作一段时间后应补充KOH |
分析 燃料原电池中,甲烷失电子发生氧化反应,所以通入燃料的电极为负极,通入氧化剂的电极为正极;电池总反应为:CH4+2OH-+2O2=CO32-+3H2O,根据电池反应判断溶液中氢氧化钾浓度的变化,放电时,溶液中阴离子流向负极,阳离子流向正极,据此分析.
解答 解:A、燃料原电池中,甲烷失电子发生氧化反应,所以通入燃料的电极为负极,故A正确;
B、正极上氧气得电子发生还原反应,故B错误;
C、放电时,溶液中阴离子流向负极,阳离子流向正极,所以溶液中的OH-向负极移动,故C正确;
D、电池反应式为:CH4+2OH-+2O2=CO32-+3H2O,随着反应的进行,溶液中氢氧根离子不断减少,所以该电池使用一段时间后应补充KOH,故D正确;
故选B.
点评 本题考查碱性甲烷电池的工作原理,题目难度不大,注意把握电极反应式的书写,正确判断两极的化学反应,在学习中注意归纳电子、电流、离子的流向.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
5. 近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n.已知最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高,遇水会反应.Al2H6球棍模型如图.下列有关说法不正确的是( )
近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n.已知最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高,遇水会反应.Al2H6球棍模型如图.下列有关说法不正确的是( )
 近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n.已知最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高,遇水会反应.Al2H6球棍模型如图.下列有关说法不正确的是( )
近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n.已知最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高,遇水会反应.Al2H6球棍模型如图.下列有关说法不正确的是( )| A. | 氢铝化合物可能成为未来的燃料 | |
| B. | Al2H6中含有非极性键 | |
| C. | Al2H6是分子晶体 | |
| D. | Al2H6与水反应生成氢氧化铝和氢气 |
2.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 1molN2所含有的原子数为NA | |
| B. | 标准状况下,22.4L水中含有的水分子数为NA | |
| C. | Na2O2和CO2的反应中,每有1molNa2O2参加反应转移电子数为2NA | |
| D. | 16 gO2分子和16 gO3分子所含的氧原子数目相等 |
6.今有室温下有四种溶液,有关叙述不正确的是( )
| ① | ② | ③ | ④ | |
| pH | 11 | 11 | 3 | 3 |
| 溶液 | 氨水 | NaOH溶液 | 醋酸 | 盐酸 |
| A. | 分别加水稀释10倍,四种溶液的pH①>②>④>③ | |
| B. | ①加入适量的氯化铵晶体后,溶液的pH减小 | |
| C. | ①溶液中c(NH4+)+c(H+)大于④中的c(Cl-)+c(OH-) | |
| D. | VaL④与VbL②溶液混合后,若混合后溶液PH=4,则Va:Vb=11:9 |
7.下列说法不正确的是( )
| A. | 12C与14C为不同核素 | B. | 石墨和C60互为同素异形体 | ||
| C. | H2O和D2O互为同位素 | D. | ${\;}_{17}^{35}$X与${\;}_{17}^{37}$Y 为同种元素 |
 已知有关热化学方程式为:①4NH3(g)+5O2(g)4NO(g)+6H2O(g)△H=-905kJ/mol;②3H2(g)+N2(g)2NH3(g)△H=-92.4kJ/mol;③2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol;④N2(g)+O2(g)=2NO(g)△H=QkJ/mol;反应①中有关化学键的键能(kJ/mol)如下:H-O:463,H-N:391,O=O:497
已知有关热化学方程式为:①4NH3(g)+5O2(g)4NO(g)+6H2O(g)△H=-905kJ/mol;②3H2(g)+N2(g)2NH3(g)△H=-92.4kJ/mol;③2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol;④N2(g)+O2(g)=2NO(g)△H=QkJ/mol;反应①中有关化学键的键能(kJ/mol)如下:H-O:463,H-N:391,O=O:497
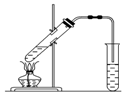 实验室用如图所示的装置制取乙酸乙酯.
实验室用如图所示的装置制取乙酸乙酯.