题目内容
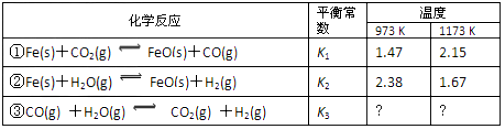
12.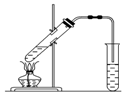 实验室用如图所示的装置制取乙酸乙酯.
实验室用如图所示的装置制取乙酸乙酯.(1)在试管中配制一定比例的乙醇、乙酸和浓硫酸的混合溶液,其方法是在一个30mL的大试管中注入3 mL乙醇,再分别缓缓加入2 mL浓硫酸、3mL乙酸(乙醇和浓硫酸的加入顺序不可互换).
(2)装置中通蒸气的导管应置于饱和碳酸钠溶液的液面上而不能插入溶液中,目的是防止溶液倒吸,造成倒吸的原因是乙醇、乙酸易溶于水.
(3)写出该反应的化学方程式CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O.
(4)饱和碳酸钠溶液的作用是吸收除去挥发出来的乙酸和乙醇、降低乙酸乙酯的溶解度.
(5)反应时生成的乙酸乙酯密度比水小,有芳香气味.
分析 由图可知,试管中先加乙醇、再加浓硫酸,最后加乙酸,加热发生酯化反应生成密度比水小、具有芳香气味的乙酸乙酯,后面的小试管中为饱和碳酸钠溶液,乙醇、乙酸易溶于水,要防止倒吸,且饱和碳酸钠可吸收乙醇、除去乙酸、降低乙酸乙酯的溶解度,分液可分离,以此来解答.
解答 解:(1)浓硫酸溶于水放出大量的热,乙醇中含有少量水,应将浓硫酸加入到乙醇中,防止硫酸溶解时放出大量的热导致液体飞溅,另外,加热时,试管内液体的体积不超过试管容积的$\frac{1}{3}$,加入药品的顺序为在一个30mL大试管中注入3mL乙醇,再分别缓缓加入2mL浓硫酸和3mL乙酸(乙酸和浓硫酸的加入顺序可互换),边加边振荡试管使之混合均匀(药品总用量不能超过10mL),
故答案为:在一个30mL的大试管中注入3 mL乙醇,再分别缓缓加入2 mL浓硫酸、3mL乙酸(乙醇和浓硫酸的加入顺序不可互换);
(2)装置中通蒸气的导管应置于饱和碳酸钠溶液的液面上而不能插入溶液中,目的是防止溶液倒吸,造成倒吸的原因是乙醇、乙酸易溶于水,
故答案为:乙醇、乙酸易溶于水;
(3)酯化反应的本质为酸脱羟基,醇脱氢,在A中乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应方程式为CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O,故答案为:CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O;
(4)乙醇与乙酸都易挥发,制备的乙酸乙酯含有乙醇与乙酸,通常用饱和碳酸钠溶液吸收乙酸乙酯,中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,溶解挥发出来的乙醇,降低乙酸乙酯在水中的溶解度,便于分层得到酯;
故答案为:吸收除去挥发出来的乙酸和乙醇、降低乙酸乙酯的溶解度;
(5)产物乙酸乙酯在上层,所以密度比水小,且乙酸乙酯具有芳香气味,故答案为:小;芳香.
点评 本题考查乙酸乙酯的制备实验,为高频考点,把握制备原理、混合物分离提纯、实验技能等为解答的关键,侧重分析与实验能力的考查,注意有机物性质的应用,题目难度不大.

| A. | 实验室蒸馏石油时,蒸馏烧瓶中加入一些碎瓷片,为防止暴沸,冷凝管下口进冷水上口出热水 | |
| B. | 实验室制备硝基苯时,将硝酸与苯混合后再滴加浓硫酸 | |
| C. | 实验使手指不小心沾上苯酚,立即用70℃以上的热水清洗 | |
| D. | 检验蔗糖是否水解:蔗糖溶液在稀硫酸存在下水浴加热一点时间后,再与银氨溶液混合加热,观察现象 |
| A. | 分子式为C3H8O并能与金属钠反应放出氢气的有机化合物有3种 | |
| B. | 甲苯在一定条件下与H2完全加成,加成后的产物其一氯代物的同分异构体有5种 | |
| C. | 甲醇,乙二醇互为同系物 | |
| D. | 1mol某烷烃完全燃烧消耗11mol O2,则其主链上含有5个碳原子的同分异构体(不考虑空间异构)有6种 |
| A. | 通入CH4的电极为负极 | B. | 正极发生氧化反应 | ||
| C. | 溶液中的OH-向负极移动 | D. | 工作一段时间后应补充KOH |
| A. | 原子中核内质子数和核外电子数一定相等 | |
| B. | 溶液稀释前后溶质的质量一定相等 | |
| C. | 常温常压下,酸碱中和反应生成1mol液态水时放出的热量一定相等 | |
| D. | 物质发生化学变化前后,元素的种类一定相等 |
①正丁烷 ②异丁烷 ③正戊烷 ④异戊烷 ⑤新戊烷.
| A. | ①>②>③>④>⑤ | B. | ③>④>⑤>①>② | C. | ⑤>④>③>②>① | D. | ②>①>⑤>④>③ |
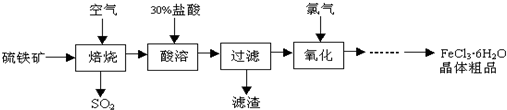
 +6SO2,则
+6SO2,则 中的化学式为Fe3O4,反应中化合价升高的元素有铁、硫.
中的化学式为Fe3O4,反应中化合价升高的元素有铁、硫. 铁、铜及其化合物在日常生产、生活有着广泛的应用.请回答下列问题:
铁、铜及其化合物在日常生产、生活有着广泛的应用.请回答下列问题: