题目内容
向500mL Na2SO4和Na2CO3的混合溶液中加入过量的BaCl2溶液,得105.7g白色沉淀,向白色沉淀中再加入过量的稀HCl,充分反应后,剩余沉淀46.6g,并有气体产生.
(1)原溶液中Na+的物质的量是多少?
(2)原混合物溶液中Na2SO4和Na2CO3的物质的量浓度各是多少?
(3)产生的气体在标准状况下的体积是多少升?
(1)原溶液中Na+的物质的量是多少?
(2)原混合物溶液中Na2SO4和Na2CO3的物质的量浓度各是多少?
(3)产生的气体在标准状况下的体积是多少升?
考点:有关混合物反应的计算
专题:
分析:105.7g白色沉淀是BaCO3和BaSO4混合物,BaSO4不溶于水与盐酸,BaCO3溶于盐酸,故白色沉淀中加入过量的稀HCl,充分反应后,剩余沉淀46.6g为BaSO4的质量,可得BaCO3的质量为105.7g-46.6g=59.1g,根据n=
计算BaCO3和BaSO4的物质的量,Na2SO4的物质的量等同于BaSO4的物质的量,Na2CO3的物质的量等同于BaCO3的物质的量,进而可计算原溶液中Na+的物质的量,再根据c=
计算原混和溶液中Na2CO3和Na2SO4的物质的量浓度;结合反应的方程式计算生成气体的体积.
| m |
| M |
| n |
| V |
解答:
解:105.7g白色沉淀是BaCO3和BaSO4混合物,BaSO4不溶于水与盐酸,BaCO3溶于盐酸,故白色沉淀中加入过量的稀HCl,充分反应后,剩余沉淀46.6g为BaSO4的质量,可得BaCO3的质量为105.7g-46.6g=59.1g,BaSO4的物质的量为
=0.2mol,由硫酸根守恒可知n(Na2SO4)=n(BaSO4)=0.2mol,
n(BaCO3)=
=0.3mol,由碳酸根守恒可知n(Na2CO3)=n(BaCO3)=0.3mol,
(1)原溶液中Na+的物质的量是n(Na+)=2n(Na2CO3)+2n(Na2SO4)=2×0.3mol+2×0.2mol=1mol,
答:原溶液中Na+的物质的量是1mol;
(2)c(Na2SO4)=
=0.4mol/L,c(Na2CO3)=
=0.6mol/L,
答:原混合物溶液中Na2SO4和Na2CO3的物质的量浓度各是0.4mol/L、0.6mol/L;
(3)发生反应BaCO3+2HCl═BaCl2+H2O+CO2↑,由方程式可知n(CO2)=n(BaCO3)=0.3mol,故生成的二氧化碳的体积为0.3mol×22.4L/mol=6.72L,
答:产生的气体在标准状况下的体积是6.72L.
| 46.6g |
| 233g/mol |
n(BaCO3)=
| 59.1g |
| 197g/mol |
(1)原溶液中Na+的物质的量是n(Na+)=2n(Na2CO3)+2n(Na2SO4)=2×0.3mol+2×0.2mol=1mol,
答:原溶液中Na+的物质的量是1mol;
(2)c(Na2SO4)=
| 0.2mol |
| 0.5L |
| 0.3mol |
| 0.5L |
答:原混合物溶液中Na2SO4和Na2CO3的物质的量浓度各是0.4mol/L、0.6mol/L;
(3)发生反应BaCO3+2HCl═BaCl2+H2O+CO2↑,由方程式可知n(CO2)=n(BaCO3)=0.3mol,故生成的二氧化碳的体积为0.3mol×22.4L/mol=6.72L,
答:产生的气体在标准状况下的体积是6.72L.
点评:本题考查混合物的有关计算,为高频考点,侧重于学生的分析和计算能力的考查,难度不大,清楚反应过程理解沉淀质量减少的原因是关键.

练习册系列答案
相关题目
下列物质中,属于含有极性共价键的离子化合物的是( )
| A、HCl |
| B、NaCl |
| C、NaOH |
| D、CO2 |
NA表示阿伏加德罗常数的值,下列说法不正确的是( )
| A、64g氧气中含氧分子数为2NA |
| B、1.7gOH-中所含的电子数为NA |
| C、49g硫酸中所含氧原子数为2NA |
| D、58.5g氯化钠中所含的离子数为NA |
在容积不变的密闭容器中存在如下反应2SO2(g)+O2(g)?2SO3(g)△H<0,某研究小组探究其他条件下不变时,改变某一条件对上述反应的影响,下列分析正确的是( )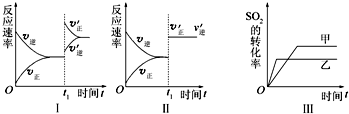

| A、图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响 |
| B、图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响 |
| C、图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙的高 |
| D、图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高 |
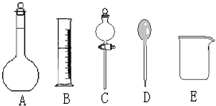 我校环保兴趣小组在处理污水样品时,需用质量分数为37%的浓盐酸(密度为1.19g/cm3)配制成250mL 0.1mol?L-1的盐酸溶液.
我校环保兴趣小组在处理污水样品时,需用质量分数为37%的浓盐酸(密度为1.19g/cm3)配制成250mL 0.1mol?L-1的盐酸溶液.