题目内容
为了达到下表中的实验要求,请从供选择的化学试剂及实验方法中选出合适的,将其标号填入对应的空格中.
供选择的化学试剂及实验方法如下:
A、加入足量的稀盐酸,溶解,过滤
B、加入足量的氢氧化钠溶液,溶解,过滤
C、通入Cl2气体
D、加入足量的铁粉.
供选择的化学试剂及实验方法如下:
| 实验要求 | 选项的标号 |
| 除去FeCl2溶液中的少量FeCl3 | |
| 除去FeCl3溶液中的少量FeCl2 | |
| 除去SiO2中Al2O3 | |
| 除去Fe2O3中Al2O3 |
B、加入足量的氢氧化钠溶液,溶解,过滤
C、通入Cl2气体
D、加入足量的铁粉.
考点:物质分离、提纯的实验方案设计
专题:实验设计题,化学实验基本操作
分析:根据FeCl2具有还原性,FeCl3具有氧化性,二者可相互转化,Al2O3为两性氧化物的性质解答该题.
解答:
解:FeCl3可与铁反应生成FeCl2,除去FeCl2溶液中的少量FeCl3,则可加入足量的铁粉除杂;
FeCl2可与氯气反应生成FeCl3,除去FeCl3溶液中的少量FeCl2,可通入Cl2气体;
Al2O3可与强酸反应,除去SiO2中Al2O3,加入足量的稀盐酸,溶解,过滤;
Al2O3可与强碱反应,除去Fe2O3中Al2O3,可加入足量的氢氧化钠溶液,溶解,过滤.
故答案为:B;C;A;D.
FeCl2可与氯气反应生成FeCl3,除去FeCl3溶液中的少量FeCl2,可通入Cl2气体;
Al2O3可与强酸反应,除去SiO2中Al2O3,加入足量的稀盐酸,溶解,过滤;
Al2O3可与强碱反应,除去Fe2O3中Al2O3,可加入足量的氢氧化钠溶液,溶解,过滤.
故答案为:B;C;A;D.
点评:本题考查物质的分离、提纯的实验涉及,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质的异同,为解答该题的关键,难度不大.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
根据下列反应判断还原剂的还原性由强到弱的顺序,正确的是( )
①Cl2+2KI═I2+2KCl
②2FeCl3+2HI═I2+2FeCl2+2HCl
③2FeCl2+Cl2═2FeCl3
④I2+SO2+2H2O═2HI+H2SO4.
①Cl2+2KI═I2+2KCl
②2FeCl3+2HI═I2+2FeCl2+2HCl
③2FeCl2+Cl2═2FeCl3
④I2+SO2+2H2O═2HI+H2SO4.
| A、SO2>I->Fe2+>Cl- |
| B、Cl2>Fe3+>I2>SO2 |
| C、Fe2+>Cl->I->SO2 |
| D、Cl->Fe2+>I->SO2 |
设NA为阿伏加德罗常数,下列叙述中正确的是( )
| A、标准状况下,22.4LH2O所含有的原子数目为3NA |
| B、标准状况下,22.4 L H2中含质子数为2NA |
| C、100mL 0.1mol?L-1稀硫酸中含有硫酸根个数为0.1NA |
| D、常温常压下,48 g 03含有的氧原子数为NA |
某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g);△H<0.如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是( )
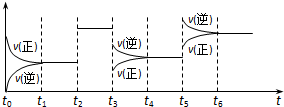

| A、t5时增大了压强 |
| B、t3时降低了温度 |
| C、t2时加入了催化剂 |
| D、t4~t5时间内转化率一定最低 |
已知反应A2(g)+2B2(g)?2AB2(g)△H<0,下列说法正确的是( )
| A、升高温度,正向反应速率增加,逆向反应速率减小 |
| B、升高温度有利于反应速率增加,从而缩短达到平衡的时间 |
| C、达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动 |
| D、达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动 |
