题目内容
NA表示阿伏加德罗常数的值,下列说法不正确的是( )
| A、64g氧气中含氧分子数为2NA |
| B、1.7gOH-中所含的电子数为NA |
| C、49g硫酸中所含氧原子数为2NA |
| D、58.5g氯化钠中所含的离子数为NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、根据n=
计算出氧气的物质的量,再计算出氧气分子的数目;
B、根据n=
计算出氢氧根离子的物质的量,再计算出含有的电子数;
C、根据n=
计算出硫酸的物质的量,再计算出含有的氧原子数目;
D、根据n=
计算出氯化钠的物质的量,再计算出含有的离子数.
| m |
| M |
B、根据n=
| m |
| M |
C、根据n=
| m |
| M |
D、根据n=
| m |
| M |
解答:
解:A、64g氧气的物质的量为2mol,含氧分子数为2NA,故A正确;
B、1.7g氢氧根离子的物质的量为0.1mol,含有1mol电子,所含的电子数为NA,故B正确;
C、49g硫酸的物质的量为0.5mol,含有2mol氧原子,所含氧原子数为2NA,故C正确;
D、58.5g氯化钠的物质的量为1mol,含有1mol钠离子和1mol氯离子,总共含有2mol离子,所含的离子数为2NA,故D错误;
故选D.
B、1.7g氢氧根离子的物质的量为0.1mol,含有1mol电子,所含的电子数为NA,故B正确;
C、49g硫酸的物质的量为0.5mol,含有2mol氧原子,所含氧原子数为2NA,故C正确;
D、58.5g氯化钠的物质的量为1mol,含有1mol钠离子和1mol氯离子,总共含有2mol离子,所含的离子数为2NA,故D错误;
故选D.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,阿伏加德罗常数是高考的“热点”,它既考查了学生对物质的量、粒子数、质量、体积等与阿伏加德罗常数关系的理解,又可以涵盖多角度的化学知识内容.要准确解答好这类题目,既要掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,还要准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列反应能用离子方程式CO32-+2H+=CO2↑+H2O表示的是( )
| A、NaHCO3+HCl=NaCl+CO2↑+H2O |
| B、BaCO3+2HCl=BaCl2+H2O+CO2↑ |
| C、Na2CO3+H2SO4=Na2SO4+CO2↑+H2O |
| D、K2CO3+2CH3COOH=2CH3COOK+CO2↑+H2O |
下列离子方程式书写正确的是( )
| A、大理石和稀盐酸反应 CO32-+2H+═CO2↑+H2O |
| B、铜和稀硝酸反应 3Cu+8H++2 NO3-═3Cu2++2NO↑+4H2O |
| C、金属钠和水反应 Na+H2O═Na++2OH-+H2↑ |
| D、氧化铝和烧碱溶液反应 A12O3+2OH-═A1O2-+H2O |
四种短周期元素在周期表中的位置如右图,其中只有M为金属元素.下列说法错误的是( )
| Y | |||
| M | X | Z |
| A、钠与Z可能形成Na2Z2化合物 |
| B、由X与氧组成的物质在熔融时能导电 |
| C、Y的最简单气态氢化物的热稳定性比X的强 |
| D、M的简单离子半径是同周期中简单离子半径最小的 |
设NA为阿伏加德罗常数,下列叙述中正确的是( )
| A、标准状况下,22.4LH2O所含有的原子数目为3NA |
| B、标准状况下,22.4 L H2中含质子数为2NA |
| C、100mL 0.1mol?L-1稀硫酸中含有硫酸根个数为0.1NA |
| D、常温常压下,48 g 03含有的氧原子数为NA |
一定温度下的反应A(g)+3B(g)?2C(g),下列叙述不能表明它达到化学平衡的是( )
| A、A、B、C的浓度不再变化 |
| B、混合气体的总物质的量不再变化 |
| C、单位时间内a mol A生成,同时生成3a mol B |
| D、C的生成速率与C的分解速率相等 |
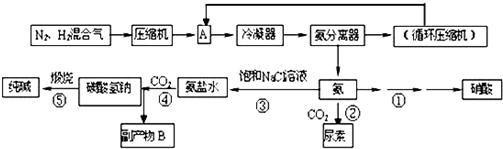
 反应②的化学方程式是
反应②的化学方程式是