题目内容
4. 将一定质量的镁铝合金投入200mL 一定浓度的盐酸中,合金完全溶解.
将一定质量的镁铝合金投入200mL 一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加5.0mol.L-1NaOH溶液,生成沉淀的质量跟加入NaOH溶液的体积的关系如图所示.(横坐标体积的单位是mL,纵坐标质量的单位是g)
(1)NaOH溶液0-40 mL区间所发生反应的离子方程式为:H++OH-=H2O.
(2)NaOH溶液160-180mL区间所发生反应的离子方程式为:OH-+Al(OH)3=AlO2-+2H2O.
(3)NaOH溶液滴加到160mL时,溶液中的溶质组成为NaCl.
(4)合金中镁的质量为3.6g.
(5)所用盐酸的物质的量浓度为8 mol.L-1.
分析 (1)NaOH溶液0-40 mL区间没有生成沉淀,说明盐酸有剩余,剩余的盐酸与氢氧化钠溶液反应生成氯化钠和水;
(2)NaOH溶液160-180mL区间沉淀溶解,发生反应为氢氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水;
(3)从加入40m氢氧化钠溶液开始产生沉淀,加入氢氧化钠溶液为160mL时,沉淀量最大,此时沉淀为Mg(OH)2和Al(OH)3,反应后溶质为氯化钠;
(4)根据图象可知,16.5g沉淀为氢氧化铝和氢氧化镁的混合物,7.8g为氢氧化镁,根据n=$\frac{m}{M}$计算出氢氧化镁的物质的量,再根据质量守恒定律得出Mg的物质的量,最后根据m=nM计算出Mg的质量;
(5)加入氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液为氯化钠溶液,根据钠元素守恒此时溶液中n(NaCl)=n(NaOH),据此计算出n(HCl),再利用c=$\frac{n}{V}$计算盐酸的物质的量浓度.
解答 解:(1)由图可知,从开始至加入NaOH溶液40mL,没有沉淀生成,说明原溶液中盐酸溶解Mg、Al后盐酸有剩余,此时发生的反应为:HCl+NaOH=NaCl+H2O,离子方程式为H++OH-=H2O,
故答案为:H++OH-=H2O;
(2)NaOH溶液160-180mL区间沉淀部分溶解,发生反应为:Al(OH)3+NaOH=NaAlO2+2H2O,其离子方程式为:OH-+Al(OH)3=AlO2-+2H2O,
故答案为:OH-+Al(OH)3=AlO2-+2H2O;
(3)根据图象曲线变化可知,加入40m氢氧化钠溶液开始产生沉淀,加入氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,反应后溶质为NaCl,
故答案为:NaCl;
(4)加入氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,根据图象可知,氢氧化铝和氢氧化镁的总质量为16.5g,
加入180mL氢氧化钠溶液时,剩余的8.5g沉淀为氢氧化镁,n[Mg(OH)2]=$\frac{7.8g}{58g/mol}$=0.15mol
由元素守恒可知:n(Mg)=n[Mg(OH)2]=0.15mol,
所以Mg的质量为:0.15mol×24g/mol=3.6g,
故答案为:3.6;
(5)加入氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液为NaCl溶液,
根据钠元素守恒此时溶液中:n(NaCl)=n(NaOH)=0.16L×5mol/L=0.8mol,
根据氯元素守恒n(HCl)=0.8mol,
故盐酸的物质的量浓度为:$\frac{0.8mol}{0.1L}$=8mol/L,
答:盐酸的物质的量浓度为8mol/L.
点评 本题考查镁铝化合物性质、混合物的计算,题目难度中等,以图象题的形式考查,增加了试题难度,分析图象各阶段的发生的反应是解题关键,再利用守恒计算,试题培养了学生的化学计算能力.

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案| A. | 合成氨的化学反应限度最大 | |
| B. | N2的转化率最高 | |
| C. | 催化剂的活性最大 | |
| D. | NH3在平衡混合气体中的体积分数最大 |
| A. | 都能使品红试液褪色 | |
| B. | 都能和氢氧化钠溶液反应生成盐和水 | |
| C. | 都有刺激性气味 | |
| D. | 常温下都是气体 |
| A. | 自然界里没有任何一种食物能同时满足人体对各种维生素的需要 | |
| B. | 用于2008年北京奥运“祥云”火炬的丙烷是一种清洁燃料 | |
| C. | 用大米酿的酒在一定条件下密封保存,时间越长越香醇 | |
| D. | 葡萄糖、蔗糖、纤维素和脂肪在一定条件下都可以发生水解反应 |

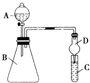 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验:
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验: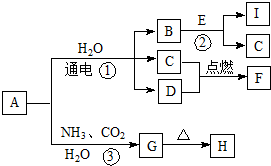 中学化学中的一些常见物质有下图转化关系(部分产物未给出).其中A的焰色呈黄色,D常温下为黄绿色气体,反应③为侯氏制碱法反应原理之一,E是常见的金属.
中学化学中的一些常见物质有下图转化关系(部分产物未给出).其中A的焰色呈黄色,D常温下为黄绿色气体,反应③为侯氏制碱法反应原理之一,E是常见的金属.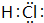 .
.