题目内容
13.常温下,某一元酸HA的Ka=2×10-5,则0.05mol/L该酸溶液的PH值=3.分析 由HA?H++Ac-,设c(H+)=c(Ac-)=amol/L,则电离平衡常数为$\frac{{a}^{2}}{0.05}$=2×10-5,所以a=10-3mol/L,根据PH=-lgc(H+)求PH值.
解答 解:由HA?H++Ac-,设c(H+)=c(Ac-)=amol/L,则电离平衡常数为$\frac{{a}^{2}}{0.05}$=2×10-5,所以a=10-3mol/L,所以PH=-lgc(H+)=-lg10-3=3,故答案为:3.
点评 本题考查弱酸的电离,明确离子的浓度、电离平衡常数的计算即可解答,难度不大.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
4.已知金属钠和水反应的化学方程式为:2Na+2H2O═2NaOH+H2↑.将9.2g金属钠投入到足量的重水D2O中,则产生的气体中含有( )
| A. | 0.2 mol中子 | B. | 0.4 mol电子 | C. | 0.2 mol质子 | D. | 0.4 mol分子 |
1. 反应:L(s)+aG(g)?bR(g)达到平衡,温度和压强对该反应的影响如图所示,图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气体中G的体积分数.据此可判断( )
反应:L(s)+aG(g)?bR(g)达到平衡,温度和压强对该反应的影响如图所示,图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气体中G的体积分数.据此可判断( )
 反应:L(s)+aG(g)?bR(g)达到平衡,温度和压强对该反应的影响如图所示,图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气体中G的体积分数.据此可判断( )
反应:L(s)+aG(g)?bR(g)达到平衡,温度和压强对该反应的影响如图所示,图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气体中G的体积分数.据此可判断( )| A. | 上述反应是放热反应 | B. | a>b | ||
| C. | 上述反应是吸热反应 | D. | 无法确定a、b的大小 |
8.下列能正确表示乙烯结构简式的是( )
| A. | C2H4 | B. | CH2 CH2 | C. | CH2--CH2 | D. | CH2=CH2 |
5.目前银川一中部分学生喜欢使用胶带,四氟乙烯(C2F4)是制作胶带胶黏剂的一种原料.
下面是关于四氟乙烯的几种说法:
①它是由碳、氟两种元素组成的化合物,
②它是由氟气(分子式为:F2)和碳组成的化合物
③它的分子中碳、氟两种元素的原子物质的量比为1:2
这些说法中正确的是( )
下面是关于四氟乙烯的几种说法:
①它是由碳、氟两种元素组成的化合物,
②它是由氟气(分子式为:F2)和碳组成的化合物
③它的分子中碳、氟两种元素的原子物质的量比为1:2
这些说法中正确的是( )
| A. | ①② | B. | ②③ | C. | ①③ | D. | ①②③ |
2.NA为阿伏加德罗常数,下列分子数最少的是( )
| A. | 标准状况下2.24L氨气 | B. | 0.8mol氧气 | ||
| C. | 3.6g水 | D. | 含NA个氢分子的氢气 |
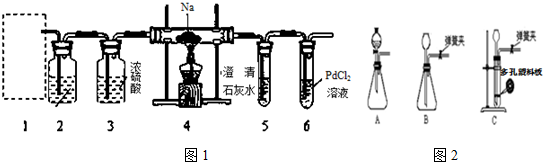
 .
.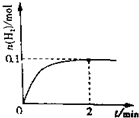 空气中的污染物主要来源为燃煤、机动车尾气等.因此,CO、SO2、NOx等进行研究具有重要意义.请回答下列问题:
空气中的污染物主要来源为燃煤、机动车尾气等.因此,CO、SO2、NOx等进行研究具有重要意义.请回答下列问题: