题目内容
图中A~J分别代表有关反应中的一种物质,它们均为中学化学中的常见物质.已知A~E和F~J中分别含有同一种元素.反应E→A+O2的条件未标出.A和F高温下反应属于置换反应,A为单质.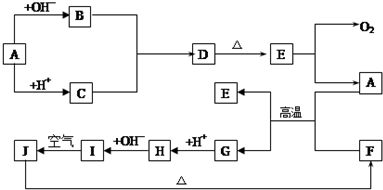
请填写下列空白:
(1)A的化学式 ,I的化学式为 .
(2)化合物H中的阳离子是 ;检验方法 .
(3)A生成B反应的离子方程式是 .
(4)A和F的混合物发生反应的化学方程式是 .
(5)写出B与C生成D的离子方程式 .
(6)I→J反应的现象是 .

请填写下列空白:
(1)A的化学式
(2)化合物H中的阳离子是
(3)A生成B反应的离子方程式是
(4)A和F的混合物发生反应的化学方程式是
(5)写出B与C生成D的离子方程式
(6)I→J反应的现象是
考点:无机物的推断,常见金属元素的单质及其化合物的综合应用
专题:推断题,几种重要的金属及其化合物
分析:A为单质,由A既能与酸反应又能与碱反应,且E电解生成A和氧气,则A为Al,E为Al2O3,D分解生成E,所以D为Al(OH)3,B中含AlO2-,C中含Al3+;由转化图可知,A与F的反应为铝热反应,F为Fe2O3,G为Fe,H中含有Fe2+,I为Fe(OH)2,I能被氧化,J分解生成F,则J为Fe(OH)3,然后结合物质的性质及题目要求来解答.
解答:
解:A为单质,由A既能与酸反应又能与碱反应,且E电解生成A和氧气,则A为Al,E为Al2O3,D分解生成E,所以D为Al(OH)3,B中含AlO2-,C中含Al3+;由转化图可知,A与F的反应为铝热反应,F为Fe2O3,G为Fe,H中含有Fe2+,I为Fe(OH)2,I能被氧化,J分解生成F,则J为Fe(OH)3,
(1)由上述分析可知,A为Al,I为Fe(OH)2,故答案为:Al;Fe(OH)2;
(2)H中含有Fe2+,检验方法为向溶液中加入KSCN,溶液无变化,再加入氯水,溶液变为血红色,则证明溶液中有Fe2+,
故答案为:Fe2+;向溶液中加入KSCN,溶液无变化,再加入氯水,溶液变为血红色,则证明溶液中有Fe2+;
(3)A生成B反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4)A和F的混合物发生反应的化学方程式为2Al+Fe2O3
2Fe+Al2O3,故答案为:2Al+Fe2O3
2Fe+Al2O3;
(5)B与C生成D的离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3↓,故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓;
(6)I→J反应的现象是白色沉淀迅速变灰绿最后变为红褐色,故答案为:白色沉淀迅速变灰绿最后变为红褐色.
(1)由上述分析可知,A为Al,I为Fe(OH)2,故答案为:Al;Fe(OH)2;
(2)H中含有Fe2+,检验方法为向溶液中加入KSCN,溶液无变化,再加入氯水,溶液变为血红色,则证明溶液中有Fe2+,
故答案为:Fe2+;向溶液中加入KSCN,溶液无变化,再加入氯水,溶液变为血红色,则证明溶液中有Fe2+;
(3)A生成B反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4)A和F的混合物发生反应的化学方程式为2Al+Fe2O3
| ||
| ||
(5)B与C生成D的离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3↓,故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓;
(6)I→J反应的现象是白色沉淀迅速变灰绿最后变为红褐色,故答案为:白色沉淀迅速变灰绿最后变为红褐色.
点评:本题考查无机物的推断,利用A的性质及E生成A来推断A是解答本题的突破口,明确各物质的推断是解答本题的关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
Al投入某无色溶液中产生H2,则下列离子一定能在此溶液中共存的是( )
| A、H+、Ca2+、Na+、HCO3- |
| B、Na+、Mg2+、Al3+、Cl- |
| C、Cu2+、Mg2+、Cl-、OH- |
| D、Ba2+、Cl-、Na+、K+ |
某元素X最高价含氧酸的化学式为HnXO2n,则X元素的最低化合价为( )
| A、3n-12 | B、3n-8 |
| C、5n-6 | D、5n-4 |
下列说法中正确的是( )
| A、1molH2O中约含有6.02×1023个H |
| B、1molCH4的体积约为22.4L |
| C、CO2的摩尔质量为44g |
| D、1molNaOH质量是40g |
设阿佛加德罗常数的数值为NA,下列说法正确的是( )
| A、标准状况下,33.6 L H2O含有1.5NA个H2O分子 |
| B、根据反应KOCN+KOH+Cl2→CO2+N2+KCl+H2O 当有12mol电子转移时,生成N2分子数为2NA |
| C、常温常压下,22.4L NO2和N2O4混合气体含有的原子数为3NA |
| D、0.10 mol Fe粉与足量水蒸气反应生成的H2分子数为0.10NA |
氢化钠是一种白色的离子化合物,其中钠元素是+l价,NaH与水反应放出H2,下列叙述正确的是( )
| A、该反应中NaH作氧化剂 |
| B、该反应中水的H元素部分被氧化成氢气 |
| C、NaH溶于水后溶液显碱性 |
| D、该反应的氧化产物与还原产物质量之比为1:1 |
下列表示对应化学反应的离子方程式正确的是( )
| A、漂白粉露置在空气中失效:ClO-+CO2+H2O=HClO+HCO3- |
| B、向NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- |
| C、向Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O=2SO32-+4Cl-+6H+ |
| D、在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+Fe(OH)3=FeO42-+3Cl-+H2O+4H+ |
