题目内容
5.氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域.在一定条件下,氮化铝可通过如下反应合成:Al2O3+N2+3C $\stackrel{高温}{?}$2AlN+3CO,下列叙述正确的是( )| A. | 在氮化铝的合成反应中,N2是还原剂,Al2O3氧化剂 | |
| B. | 上述反应中每生成2molAlN,N2得到3mol电子 | |
| C. | 氮化铝中氮元素的化合价为-3 | |
| D. | 氮化铝是铝合金中的一种 |
分析 A.Al2O3+N2+3C $\frac{\underline{\;高温\;}}{\;}$2AlN+3CO中,N元素化合价降低,N2为氧化剂,C元素化合价升高,C为还原剂;
B.结合元素化合价的变化和化学方程式定量关系计算电子转移的数目;
C.元素化合价代数和为0计算元素化合价;
D.氮化铝是一种共价化合物;
解答 解:A.在氮化铝的合成反应中,N2是氧化剂,Al2O3既不是氧化剂,也不是还原剂,故A错误;
B.上述反应中N元素化合价由0价降低到-3价,每生成2mol AlN,N2得到6mol电子,故B错误;
C.由化合价代数和为0可知,氮化铝中铝元素化合价为+3价,氮元素的化合价为-3,故C正确;
D.氮化铝是化合物,而铝合金中的铝是单质,故D错误;
故选C.
点评 本题考查氧化还原反应,题目难度不大,注意把握元素化合价的判断,从化合价变化的角度分析,题目侧重于相关概念的考查.

练习册系列答案
相关题目
15.如下图所示警示标记中,放浓硫酸的试剂瓶上应印有的( )
| A. |  | B. |  | C. |  | D. |  |
16.生活中使用的塑料食品盒、水杯等通常由聚苯乙烯制成,其结构简式为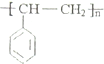 .根据所学知识,可以判断( )
.根据所学知识,可以判断( )
 .根据所学知识,可以判断( )
.根据所学知识,可以判断( )| A. | 聚苯乙烯能使溴水褪色 | |
| B. | 聚苯乙烯是一种天然高分子化合物 | |
| C. | 聚苯乙烯可由苯乙烯通过化合反应制得 | |
| D. | 聚苯乙烯单体的分子式为C8H8 |
20.有Fe2+、NO3-、Fe3+、NH4+、H+和H2O六种粒子,分别属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是( )
| A. | 氧化剂与还原剂的物质的量之比为1:8 | |
| B. | 该过程说明Fe(NO3)2溶液不宜加酸酸化 | |
| C. | 若有1 mol NO3-发生氧化反应,则转移8 mol e- | |
| D. | Fe3+的氧化性比HNO3弱 |
7.电解NaHSO3溶液产生Na2SO3和浓H2SO4的装置如图所示,其中阴极和阳极均为惰性电极,下列有关说法不正确的是(说明:阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)( )
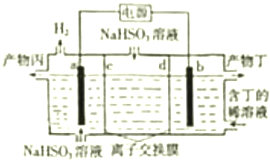

| A. | a极为阴极 | |
| B. | d为阴离子交换膜 | |
| C. | b极反应式为:HSO3-+H2O-2e-═SO42-+3H+ | |
| D. | 产物丙为硫酸溶液 |
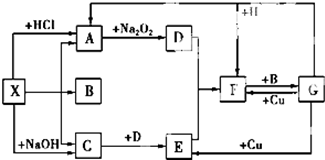 如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出.常温下X和H是固体,B和G是液体,其余均为气体,1molX分解得到A、B、C各1mol.试回答下列各题:
如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出.常温下X和H是固体,B和G是液体,其余均为气体,1molX分解得到A、B、C各1mol.试回答下列各题: