题目内容
12.表是一些共价键的键能(kJ/mol)数据,以下表达中肯定正确的是( )| 共价键 | 键能 | 共价键 | 键能 |
| H-H | 436 | H-F | 565 |
| C-F | 427 | H-S | 339 |
| C-C1 | 330 | H-Se | 314 |
| A. | H2(g)→2H(g)△H=+436kJ/mol | |
| B. | 键长越短,共价键越牢固 | |
| C. | 相同条件下CH3F比CH3C1更易发生水解反应 | |
| D. | 相同压强下,H2S的沸点比H2Se的沸点高 |
分析 A.断开化学键要吸热,且键能的单位是kJ/mol;
B.键长越短,键能越大,共价键越牢固;
C.C-F的键能比C-Cl大;
D.相对分子质量越大,分子间作用力越大,分子晶体的沸点越高.
解答 解:A.H-H的键能为436kJ/mol,所以H2(g)→2H(g)△H=+436kJ/mol,故A正确;
B.原子半径越小,原子间形成的共价键的键长越短,键能越大,共价键越牢固,故B正确;
C.C-F的键能比C-Cl大,C-F比C-Cl更稳定性,所以相同条件下CH3Cl比CH3F更易发生水解反应,故C错误;
D.相对分子质量越大,分子间作用力越大,分子晶体的沸点越高,所以相同压强下,H2S的沸点比 H2Se的沸点低,故D错误.
故选AB.
点评 本题考查了共价键的键能、键长以及键的稳定性等,题目难度不大,侧重于基础知识的考查,注意把握键的稳定性与键能的关系.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案
相关题目
2.下列关于甲烷化学性质的叙述正确的是( )
| A. | 甲烷微溶于水,其密度小于空气的密度 | |
| B. | 甲烷使溴的四氯化碳溶液褪色,发生取代反应 | |
| C. | 甲烷在氧气中燃烧,发生氧化反应 | |
| D. | 甲烷能使酸性高锰酸钾溶液褪色,发生氧化反应 |
7.电化学降解法可用于治理水中硝酸盐的污染,其工作原理如图所示.下列说法正确的是( )


| A. | A极为负极,电子从铂电极流向该极 | |
| B. | Pt电极上发生还原反应 | |
| C. | Ag-Pt电极发生的反应是:2NO3-+6H2O+10e-═N2↑+12OH- | |
| D. | 电解一段时间后,两地减少的质量一样多 |
17. 俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还会致癌.“一滴香”的分了结构如右图所示,下列说法正确的是( )
俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还会致癌.“一滴香”的分了结构如右图所示,下列说法正确的是( )
 俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还会致癌.“一滴香”的分了结构如右图所示,下列说法正确的是( )
俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还会致癌.“一滴香”的分了结构如右图所示,下列说法正确的是( )| A. | 该有机物的分子式为C7H7O3 | |
| B. | 该有机物能发生取代、加成和氧化反应 | |
| C. | 1 mol该有机物最多能与2 mol H2发生加成反应 | |
| D. | 该有机物的一种芳香族同分异构体能发生银镜反应 |
19.对于某些离子的检验及结论一定正确的是( )
| A. | 加入氢氧化钠溶液,产生蓝色淀,一定有Cu2+ | |
| B. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| C. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ca2+ | |
| D. | 加入过量盐酸,振荡、静置,再滴入氯化钡溶液,有白色沉淀产生,一定有SO42- |

 甲醇与甲醚(CH3OCH3)都可作燃料电池的燃料.
甲醇与甲醚(CH3OCH3)都可作燃料电池的燃料.
 ;装置a中的试剂是浓硫酸.
;装置a中的试剂是浓硫酸. 3-苯基丙烯醛是一种被广泛应用在食品加工中的高效低毒食品添加剂,下列是用其合成聚酯F的路线示意图:
3-苯基丙烯醛是一种被广泛应用在食品加工中的高效低毒食品添加剂,下列是用其合成聚酯F的路线示意图:
 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$ +2NaBr.
+2NaBr. +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$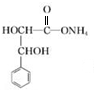 +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O. 或
或 . (任写一种)
. (任写一种) ,现以甲苯和乙醛为原料制备3-苯基丙烯醛
,现以甲苯和乙醛为原料制备3-苯基丙烯醛 ,设计合成线路(其无机试剂任选),合成线路示意图示例如下:
,设计合成线路(其无机试剂任选),合成线路示意图示例如下: