题目内容
17. 俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还会致癌.“一滴香”的分了结构如右图所示,下列说法正确的是( )
俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还会致癌.“一滴香”的分了结构如右图所示,下列说法正确的是( )| A. | 该有机物的分子式为C7H7O3 | |
| B. | 该有机物能发生取代、加成和氧化反应 | |
| C. | 1 mol该有机物最多能与2 mol H2发生加成反应 | |
| D. | 该有机物的一种芳香族同分异构体能发生银镜反应 |
分析 由结构可知分子式,含碳碳双键、羰基、-OH及醚键,结合烯烃、酮、醇的性质来解答.
解答 解:A.该有机物的分子式为C7H8O3,故A错误;
B.含-OH可发生取代、氧化反应,含碳碳双键可发生加成、氧化反应,故B正确;
C.2个双键、1个羰基均与氢气发生加成反应,则1 mol该有机物最多能与3 mol H2发生加成反应,故C错误;
D.该物质含1个环、2个双键、1个羰基,不饱和度为4,而苯环的不饱和度为4,则该有机物的一种芳香族同分异构体不含-CHO,不能发生银镜反应,故D错误;
故选B.
点评 本题考查有机物结构和性质,为高频考点,把握官能团及其性质关系、有机反应为解答本题关键,侧重分析与应用能力的考查,注意烯烃、醇的性质,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.研究表明,26Al可以衰变为26Mg,可以比较这两种元素金属性强弱的方法是( )
| A. | 比较这两种元素单质的硬度和熔点 | |
| B. | 在AlCl3和MgCl2溶液中分别滴加少量的NaOH溶液 | |
| C. | 将打磨过的镁带和铝片分别与热水作用,并向其中滴入酚酞溶液 | |
| D. | 将空气中放置已久的26Al、26Mg的单质分别与热水作用 |
5.某固体混合物可能由SiO2、Fe2O3、Fe、Na2SO3、Na2CO3、BaCl2中的两种或两种以上的物质组成.某兴趣小组为探究该固体混合物的组成,设计的部分实验方案如图所示:下列说法正确的是( )

| A. | 气体A是SO2和CO2的混合气体 | |
| B. | 固体A一定含有SiO2,可能含有BaSO4 | |
| C. | 该固体混合物中Fe2O3和Fe至少有其中一种 | |
| D. | 该固体混合物一定含有Fe、Na2SO3、BaCl2 |
12.表是一些共价键的键能(kJ/mol)数据,以下表达中肯定正确的是( )
| 共价键 | 键能 | 共价键 | 键能 |
| H-H | 436 | H-F | 565 |
| C-F | 427 | H-S | 339 |
| C-C1 | 330 | H-Se | 314 |
| A. | H2(g)→2H(g)△H=+436kJ/mol | |
| B. | 键长越短,共价键越牢固 | |
| C. | 相同条件下CH3F比CH3C1更易发生水解反应 | |
| D. | 相同压强下,H2S的沸点比H2Se的沸点高 |
2.下列关于铝及其化合物叙述中,正确的是( )
| A. | 不能用铝制的器皿来盛放酸梅汤或碱水是因为铝会和酸或碱反应 | |
| B. | 铝制品在空气中有很强的抗腐蚀性是因为铝的化学性质很稳定 | |
| C. | 铝和NaOH溶液反应:Al+2OH-═Al-+2H2↑ | |
| D. | 纯铝比铝合金的硬度更大、熔点更低 |
6.现有四种常见元素的性质或结构如表:
(1)X元素的名称是钠;Y的原子结构示意图是 ;W在元素周期表中的位置是第五周期第ⅦA族;
;W在元素周期表中的位置是第五周期第ⅦA族;
(2)请写出Al与X元素最高价氧化物所对应水化物的溶液反应的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(3)判断非金属性Z>Y(填“>”或“<”),请用离子方程式进行说明:Cl2+H2S=S+2H++2Cl-或Cl2+S2-=S+2Cl-.
| X | 与Al同周期,金属性最强 |
| Y | 与Al同周期,最外层电子数是最内层电子数的3倍 |
| Z | 常温下单质为双原子分子,为黄绿色有毒气体 |
| W | 单质紫黑色,遇淀粉溶液显蓝色 |
 ;W在元素周期表中的位置是第五周期第ⅦA族;
;W在元素周期表中的位置是第五周期第ⅦA族;(2)请写出Al与X元素最高价氧化物所对应水化物的溶液反应的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(3)判断非金属性Z>Y(填“>”或“<”),请用离子方程式进行说明:Cl2+H2S=S+2H++2Cl-或Cl2+S2-=S+2Cl-.
4.某链状有机物分子中含有m个-CH3、n个-CH2-、a个-CH-,其余为-Cl,则-Cl的数目为( )
| A. | a+2-m | B. | a+m+n | C. | 2n+3a-m | D. | 2+a+2n-m |
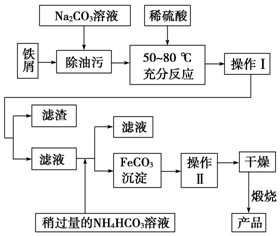 铁、铝和铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
铁、铝和铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
 ;连接装置后,检查装置气密性的方法是检查装置气密性的方法是:关闭A中分液漏斗的活塞,向E中加入蒸馏水,微热A中的圆底烧瓶,E中有气泡冒出,冷却后,E中玻璃管形成一段水柱,则气密性良好.
;连接装置后,检查装置气密性的方法是检查装置气密性的方法是:关闭A中分液漏斗的活塞,向E中加入蒸馏水,微热A中的圆底烧瓶,E中有气泡冒出,冷却后,E中玻璃管形成一段水柱,则气密性良好.