题目内容
16.0.1mol/L的二元酸H2A溶液的pH=4,下列说法正确是( )| A. | 在Na2A、NaHA两溶液中,离子种类不相同 | |
| B. | 在Na2A溶液中有:c(OHˉ)=c(HAˉ)+c(H2A)+c(H+) | |
| C. | 在NaHA溶液中有:c(Na+)+c(H+)=c(HAˉ)+2 c(A2ˉ)+c(OHˉ) | |
| D. | 在Na2A溶液中有:c(Na+)>c(A2ˉ)>c(H+)>c(OHˉ) |
分析 常温下,0.01mol/L二元酸H2A溶液的pH=3,溶液中氢离子浓度小于酸浓度,则该酸是二元弱酸,
A.在Na2A溶液中酸根离子分两步水解,NaHA中HA-离子既水解又电离;
B.根据溶液中存在的电荷守恒和物料守恒判断;
C.根据电荷守恒判断;
D.H2A属于二元弱酸,其盐会发生水解.
解答 解:常温下,0.01mol/L二元酸H2A溶液的pH=3,溶液中氢离子浓度小于酸浓度,则该酸是二元弱酸,
A.在Na2A溶液中A2-分两步水解,第一步水解生成HA-,第二步水解生成H2A,NaHA中HA-离子既水解生成H2A又电离生成A2-,任何溶液中都存在氢离子和氢氧根离子,所以两种溶液中离子种类相同,故A错误;
B.在Na2A溶液中有电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-),物料守恒为:2c(HA-)+2c(A2-)+2c(H2A)=c(Na+),由两个守恒关系式可得:c(OH-)=c(HA-)+2c(H2A)+c(H+),故B错误;
C.在NaHA溶液中,电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-),故C正确;
D.H2A属于二元弱酸,Na2A属于强碱弱酸盐,在溶液中水解显碱性,则c(OH-)>c(H+),所以在Na2A溶液中有:c(Na+)>c(A2-)>c(OH-)>c(H+),故D错误;
故选C.
点评 本题考查了弱电解质的电离、盐类水解,题目难度中等,明确弱电解质的电离、盐类水解特点是解本题关键,先根据酸浓度与pH关系确定酸的强弱,再结合电荷守恒和物料守恒来分析解答.

练习册系列答案
相关题目
6.硫酸铝、硫酸钾、明矾三种物质组成的混合物中,当SO42-的浓度为0.20mol•L-1时,加入等体积的0.20mol•L-1的KOH溶液(混合后溶液体积变化忽略不计),使生成的白色沉淀恰好溶解,那么最后混合物中K+的浓度是( )
| A. | 0.20 mol•L-1 | B. | 0.25 mol•L-1 | C. | 0.225 mol•L-1 | D. | 0.45 mol•L-1 |
7.下列关于电解质溶液的叙述不正确的是( )
| A. | pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈紫色 | |
| B. | 在pH=3 的溶液中,Na+、Cl-、Fe2+、ClO-不能大量共存 | |
| C. | 常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Clˉ)=c(NH4+)>c(H+)=c(OHˉ) | |
| D. | 向0.1mol•L-1的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/c(NH3•H2O)减小 |
4.下列依据热化学方程式得出的结论正确的是( )
| A. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| B. | 已知C(s)+O2(g)═CO2(g)△H1 C(s)+$\frac{1}{2}$O2(g)=CO(g)△H2;则△H2>△H1 | |
| C. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol | |
| D. | 放热过程(△H<0)或熵增加(△S>0)的过程一定是自发的 |
1.下列依据热化学方程式得出的结论正确的是( )
| A. | 等质量的硫磺固体和硫蒸气分别完全燃烧,后者放出的热量多 | |
| B. | △H>0表示放热反应,△H<0表示吸热反应 | |
| C. | △G>0表示反应可自发 | |
| D. | 氢气的燃烧热为285.8kJ/mol,则氢气燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(g),△H=-571.6 kJ/mol |
8.用电解法出去碱性溶液中的尿素[CO(NH2)2],装置如图所示(隔膜仅阻止气体通过,且a、b极均为惰性电极).下列说法错误的是( )
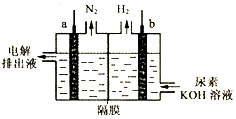

| A. | 电极b与外电源的负极相连 | |
| B. | 电解时,OH-、尿素分子均可穿过隔膜进入左室 | |
| C. | a极反应式为:CO(NH2)2-6e-+H2O═CO2↑+N2↑+6H+ | |
| D. | 每消耗1g尿素则产生标准状况下1.12LH2 |
5.短周期元素W、X、Y、Z的原子序数依次增大,其中部分元素在周期表中的位置如图所示.一个WX2分子中含有22个电子,Y的质子数是X、Z的核电荷数之和的一半.下列说法正确的是( )
| W | X | |
| Z |
| A. | 非金属性:W<Z | B. | 简单离子的半径:X2-<Y2+ | ||
| C. | 沸点:H2X<H2Z | D. | WX2的电子式为: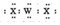 |
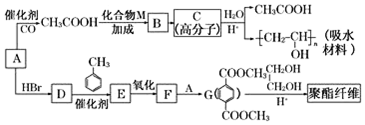
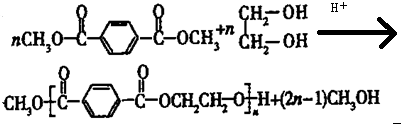 .
. 合成
合成  的流程图(注明反应条件)
的流程图(注明反应条件) .
.