题目内容
5.短周期元素W、X、Y、Z的原子序数依次增大,其中部分元素在周期表中的位置如图所示.一个WX2分子中含有22个电子,Y的质子数是X、Z的核电荷数之和的一半.下列说法正确的是( )| W | X | |
| Z |
| A. | 非金属性:W<Z | B. | 简单离子的半径:X2-<Y2+ | ||
| C. | 沸点:H2X<H2Z | D. | WX2的电子式为: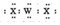 |
分析 短周期元素W、X、Y、Z的原子序数依次增大,一个WX2分子中含有22个电子,设W的质子数为x,则x+(x+2)×2=22,解得x=6,可知W为C,X为O,Z为S,Y的质子数是X、Z的核电荷数之和的一半,Y的质子数为$\frac{8+16}{2}$=12,可知Y为Mg,以此来解答.
解答 解:由上述分析可知,W为C,X为O,Y为Mg,Z为S,
A.由酸性硫酸大于碳酸可知,非金属性:W<Z,故A正确;
B.具有相同电子排布的离子中,原子序数大的离子半径小,则简单离子的半径:X2->Y2+,故B错误;
C.水分子间含氢键,则沸点为H2X>H2Z,故C错误;
D.CO2的电子式为 ,故D错误;
,故D错误;
故选A.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的位置、质子数推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
16.0.1mol/L的二元酸H2A溶液的pH=4,下列说法正确是( )
| A. | 在Na2A、NaHA两溶液中,离子种类不相同 | |
| B. | 在Na2A溶液中有:c(OHˉ)=c(HAˉ)+c(H2A)+c(H+) | |
| C. | 在NaHA溶液中有:c(Na+)+c(H+)=c(HAˉ)+2 c(A2ˉ)+c(OHˉ) | |
| D. | 在Na2A溶液中有:c(Na+)>c(A2ˉ)>c(H+)>c(OHˉ) |
20.下列有关说法正确的是( )
| A. | 分子式为C5H12O的有机物,分子中含有2个甲基的同分异构体有4种 | |
| B. | 乙烷、苯、氯乙烯等三种有机化合物分子内所有原子均在同一平面上 | |
| C. | 由乙酸和乙醇制乙酸乙酯的反应及油脂的水解反应均属于取代反应 | |
| D. | 乙烯和苯都能使溴水褪色,且褪色的原理相同 |
10.化学与生产和生活密切相关.下列叙述错误的是( )
| A. | 用食醋可除去热水壶内壁的水垢 | |
| B. | 大量燃烧化石燃料是造成雾霾天气的一种重要因素 | |
| C. | 利用纳米铁粉的物理吸附作用去除水体中的Gu2+、Hg2+等重金属离子 | |
| D. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
17.下列叙述I和Ⅱ均正确且有因果关系的是( )
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
A | 晶体硅熔点髙硬度大 | 可用于制作半导体材料 |
| B | 常温下铁与浓硫酸不反应 | 可用铁槽车密封运送浓硫酸 |
| C | NH4HCO3受热易分解 | 可用作氮肥 |
| D | HF与SiO2反应 | 氢氟酸在玻璃器皿上刻蚀标记 |
| A. | A | B. | B | C. | C | D. | D |
14.下列实验事实与相应结论不正确的是( )
| 选项 | 实验事实 | 结论 |
| A | 其他条件不变,0.01mol•L-1的酸性KMnO4溶液分别与0.1mol•L-1的H2C2O4溶液和0.2mol•L-1的H2C2O4溶液反应,后者褪色时间短 | 当其他条件不变时,增大反应物浓度可以使化学反应速率加快 |
| B | 其他条件不变,分别将等体积、等物质的量浓度的Na2S2O3溶液和H2SO4混合液放在冷水和热水中,放在热水中的混合液先出现浑浊 | 当其他条件不变时,反应体系的温度越高,化学反应速率越快 |
| C | 将少量MnO2粉末加入盛有10%双氧水的锥形瓶内,在化学反应前后,MnO2的质量和化学性质都没有发生改变 | 催化剂虽然可以加快化学反应的速率,但一定不参与化学反应过程 |
| D | 一定条件下,分别在容积为1L和容积为2L的两个密闭容器中加入等量的氢气和碘蒸气,发生如下反应:H2(g)+I2(g)?2HI(g),获得等量HI时需要的时间前者少 | 当其他条件不变时,气态反应体系的压强越大,化学反应速率越快 |
| A. | A | B. | B | C. | C | D. | D |
15.下列物质的分类正确的是( )
| 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
| A | 烧碱 | H2SO4 | BaCO3 | Na2O2 | CO2 |
| B | Ba(OH)2 | HCl | NaCl | Na2O | CO |
| C | 纯碱 | CH3COOH | CaCl2 | Al2O3 | SO2 |
| D | KOH | HClO | CaCO3 | CaO | SiO2 |
| A. | A | B. | B | C. | C | D. | D |