题目内容
18.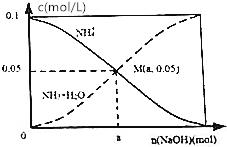 常温下,向1L 0.1mol•L-1NH4Cl溶液中,不断加入NaOH固体后,NH4+与NH3•H2O浓度的变化趋势如图所示(不考虑溶液体积变化和氨气的挥发),下列说法不正确的是( )
常温下,向1L 0.1mol•L-1NH4Cl溶液中,不断加入NaOH固体后,NH4+与NH3•H2O浓度的变化趋势如图所示(不考虑溶液体积变化和氨气的挥发),下列说法不正确的是( )| A. | M点溶液中水的电离程度比原溶液小 | |
| B. | 在M点时,n(0H-)-n(H+)=(a-0.05)mol | |
| C. | 随着Na0H的加入,$\frac{c({H}^{+})}{c(N{{H}_{4}}^{+})}$不断减小 | |
| D. | 当n(NaOH)=0.1mol时,c(0H-)>c(C1-)>c(NH3•H20) |
分析 A.M点是向1L 0.1mol•L-1NH4Cl溶液中,不断加入NaOH固体后反应得到氯化铵和一水合氨溶液,铵根离子浓度和一水合氨浓度相同,一水合氨是一元弱碱抑制水电离;
B.依据溶液中电荷守恒分析判断,n(Na+)=amol,n(Cl-)=0.1mol;
C.铵根离子水解显酸性,结合水解平衡常数分析,$\frac{c({H}^{+})}{c(N{{H}_{4}}^{+})}$×$\frac{c(N{H}_{3}•{H}_{2}O)}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{Kh}{c(N{H}_{3}•{H}_{2}O)}$;
D.向1L 0.1mol•L-1NH4Cl溶液中,不断加入NaOH固体后,当n(NaOH)=0.1mol时,恰好反应生成氯化钠和一水合氨,c(Na+)=c(Cl-)>c(OH-).
解答 解:A.M点是向1L 0.1mol•L-1NH4Cl溶液中,不断加入NaOH固体后反应得到氯化铵和一水合氨溶液,铵根离子浓度和一水合氨浓度相同,一水合氨是一元弱碱抑制水电离,此时水的电离程度小于原氯化铵溶液中水的电离程度,故A正确;
B.在M点时溶液中存在电荷守恒,n(0H-)+n(Cl-)=n(H+)+n(Na+)+n(NH4+),n(0H-)-n(H+)=0.05+n(Na+)-n(Cl-)=(a-0.05)mol,故B正确;
C.铵根离子水解显酸性,结合水解平衡常数分析,$\frac{c({H}^{+})}{c(N{{H}_{4}}^{+})}$×$\frac{c(N{H}_{3}•{H}_{2}O)}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{Kh}{c(N{H}_{3}•{H}_{2}O)}$,随氢氧化钠固体加入,反应生成一水合氨浓度增大,平衡常数不变,则$\frac{c({H}^{+})}{c(N{{H}_{4}}^{+})}$减小,故C正确;
D.向1L 0.1mol•L-1NH4Cl溶液中,不断加入NaOH固体后,当n(NaOH)=0.1mol时,恰好反应生成氯化钠和一水合氨,c(Na+)=c(Cl-)>c(OH-),故D错误;
故选D.
点评 本题考查了酸碱反应过程分析,主要是溶液酸碱性、离子浓度大小,对水的电离影响因素分析判断,题目难度中等.

 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案①二氧化碳和二氧化硅都是酸性氧化物,都能与水反应生成相应的酸
②强电解质都易溶于水
③体积为2L,物质的量浓度为0.5mol•L-1的氢氟酸中含1mol氟离子
④强酸溶液中氢离子浓度一定大于弱酸溶液中氢离子浓度
⑤电解质溶液能导电的原因是由于溶液中有自由移动的离子.
| A. | ①③⑤ | B. | ②④⑤ | C. | 只有⑤ | D. | 只有② |
| A. | 反应开始前,检查装置的气密性 | |
| B. | 加入过量稀硫酸,以确保镁带完全反应 | |
| C. | 反应停止后,立即调压并记录读数 | |
| D. | 常温下1mol氢气的体积为$\frac{V({H}_{2})}{m(Mg)}$×M(Mg) |
| A. | 酸性氧化物不一定都能与水反应生成酸 | |
| B. | 某溶液加入盐酸酸化的BaCl2溶液产生白色沉淀,则原溶液中含有SO42- | |
| C. | 丁达尔效应可以用于区别FeCl3溶液和Fe(OH)3胶体 | |
| D. | 现代化学分析测试常借助一些仪器来分析物质组成,如用原子吸收光谱确定物质中含有那些金属元素 |
| A. | 硅是制造太阳能电池的常用材料 | |
| B. | 四氧化三铁俗称铁红,可用于作油漆、红色涂料 | |
| C. | Na2O2可用作呼吸面具中的供氧剂 | |
| D. | 二氧化硅是制造光导纤维的材料 |
| A. | ①②④⑤⑥ | B. | ④⑤⑥ | C. | ②④⑤ | D. | ②③ |
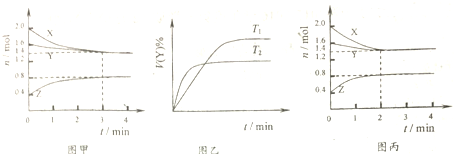
| A. | T1℃时,容器中发生的反应可表示为:3X(g)+Y(g)?2Z(g),且正反应放热 | |
| B. | T1℃时,反应进行的前3min内,用X表示的反应速率v(X)=0.2mol•(L•min)-1 | |
| C. | T1℃时,3min达到平衡后,向容器中再加入2.0mol X、1.6mol Y、0.4mol Z,反应达到新平衡时:0.7mol•L-1<c(Y)<1.4mol•L-1 | |
| D. | 若改变反应条件,使反应进程如图丙所示,则改变的条件是使用催化剂 |
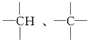 中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用n1、n2、n3、n4表示,则烷烃(除甲烷外)中存在的关系有:(用以上符号回答)
中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用n1、n2、n3、n4表示,则烷烃(除甲烷外)中存在的关系有:(用以上符号回答)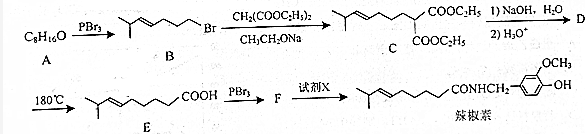
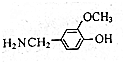 ,由B→C的反应类型是取代,
,由B→C的反应类型是取代,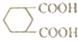 的合成路线流程图(无机试剂任用,上述流程中出现的试剂可用).合成路线流程图示例如下:CH2=CH2$\stackrel{HBr}{→}$^CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
的合成路线流程图(无机试剂任用,上述流程中出现的试剂可用).合成路线流程图示例如下:CH2=CH2$\stackrel{HBr}{→}$^CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.