题目内容
9.用镁和稀硫酸反应测定常温下1mol氢气的体积,下列叙述错误的是( )| A. | 反应开始前,检查装置的气密性 | |
| B. | 加入过量稀硫酸,以确保镁带完全反应 | |
| C. | 反应停止后,立即调压并记录读数 | |
| D. | 常温下1mol氢气的体积为$\frac{V({H}_{2})}{m(Mg)}$×M(Mg) |
分析 A.实验前需要检验装置气密性,防止装置漏气;
B.硫酸过量可以使镁完全反应;
C.反应放热,应降低温度再调压读取氢气体积;
D.根据n=$\frac{m}{M}$计算物质的量,根据Vm=$\frac{V}{n}$计算1mol气体的体积.
解答 解:A.实验需要测定生成氢气的体积,实验前需要检验装置气密性,防止装置漏气,故A正确;
B.加入过量的硫酸,可以使是镁完全反应,故B正确;
C.反应放热,气体具有热胀冷缩性质,应降低温度到室温再调压读取氢气体积,故C错误;
D.根据n=$\frac{m}{M}$可知Mg的物质的量为$\frac{m(Mg)}{M(Mg)}$,则1mol气体的体积为$\frac{V(HCl)}{\frac{m(Mg)}{M(Mg)}}$=$\frac{V({H}_{2})}{m(Mg)}$×M(Mg),故D正确,
故选:C.
点评 本题考查定量测定实验,明确原理是关键,注意读取氢气体积时应降低温度到室温,再调节压强.

练习册系列答案
相关题目
19.下列叙述正确的是( )
| A. | Fe与S混合加热生成FeS2 | |
| B. | NaHCO3的热稳定性大于Na2CO3 | |
| C. | 铁与硝酸反应后溶液中一定有Fe3+存在 | |
| D. | Zn具有还原性和导电性,可用作锌锰干电池的负极材料 |
20.下列各组中的离子,能再溶液中大量共存的是( )
| A. | H+、Na+、HCO3-、Cl- | B. | K+、Fe2+、Cl-、OH- | ||
| C. | Ag+、Al3+、NO3-、H+ | D. | Fe3+、Al3+、SCN-、Cl- |
17.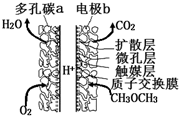 一种酸性“二甲醚(CH3OCH3)直接燃料电池”具有启动快、能量密度高、效率好等优点,其电池原理如图所示.下列有关该电池的说法不正确的是( )
一种酸性“二甲醚(CH3OCH3)直接燃料电池”具有启动快、能量密度高、效率好等优点,其电池原理如图所示.下列有关该电池的说法不正确的是( )
 一种酸性“二甲醚(CH3OCH3)直接燃料电池”具有启动快、能量密度高、效率好等优点,其电池原理如图所示.下列有关该电池的说法不正确的是( )
一种酸性“二甲醚(CH3OCH3)直接燃料电池”具有启动快、能量密度高、效率好等优点,其电池原理如图所示.下列有关该电池的说法不正确的是( )| A. | 多孔碳a能增大气固接触面积,提高反应速率,该电极为负极 | |
| B. | 电极b上发生的反应为:CH3OCH3-12e-+3H2O═2CO2+12H+ | |
| C. | H+由b电极向a电极迁移 | |
| D. | 二甲醚直接燃料电池能量密度( kW•h•kg-1)约为甲醇(CH3OH)直接燃料电池能量密度的1.4倍 |
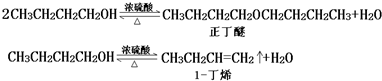
4.乙酸正丁酯是无色透明有愉快果香气味的液体,可由乙酸和正丁醇制备.反应的化学方程式如下:
CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O
发生的副反应如下:
有关化合物的物理性质见下表:
已知:乙酸正丁酯、正丁醇和水组成三元共沸物恒沸点为90.7℃.
合成:
方案甲:采用装置甲(分水器预先加入水,使水面略低于分水器的支管口),在干燥的50mL圆底烧瓶中,加入11.5mL(0.125mol)正丁醇和7.2mL(0.125mol)冰醋酸,再加入3~4滴浓硫酸和2g沸石,摇匀.按下图安装好带分水器的回流反应装置,通冷却水,圆底烧瓶在电热套上加热煮沸.在反应过程中,通过分水器下部的旋塞分出生成的水(注意保持分水器中水层液面仍保持原来高度,使油层尽量回到圆底烧瓶中).反应基本完成后,停止加热.
方案乙:采用装置乙,加料方式与方案甲相同.加热回流,反应60min后停止加热.
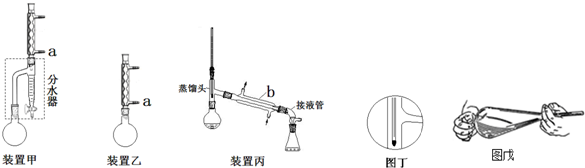
提纯:甲乙两方案均采用蒸馏方法.操作如下:

请回答:
(1)a处水流方向是进水(填“进水”或“出水”),仪器b的名称(直形)冷凝管.
(2)合成步骤中,方案甲监控酯化反应已基本完成的标志是分水器中水不再生成或分水器中的水层不再增加时.
(3)提纯过程中,步骤②是为了除去有机层中残留的酸,检验有机层已呈中性的操作是用玻璃棒蘸取有机层,点在pH试纸上,与标准比色卡对照,读取pH值判断;步骤③的目的是除去溶于酯中的少量无机盐.
(4)下列有关洗涤过程中分液漏斗的使用正确的是BC.
A.分液漏斗使用前必须要检漏,只要分液漏斗的旋塞芯处不漏水即可使用
B.洗涤时振摇放气操作应如图戊所示
C.放出下层液体时,需将玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔
D.洗涤完成后,先放出下层液体,然后继续从下口放出有机层置于干燥的锥形瓶中
(5)按装置丙蒸馏,最后圆底烧瓶中残留的液体主要是正丁醚;若按图丁放置温度计,则收集到的产品馏分中还含有正丁醇.
(6)实验结果表明方案甲的产率较高,原因是通过分水器及时分离出产物水,有利于酯化反应的进行,提高酯的产率.
CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O
发生的副反应如下:

有关化合物的物理性质见下表:
| 化合物 | 密度(g•cm-3) | 水溶性 | 沸点(℃) |
| 冰乙酸 | 1.05 | 易溶 | 118.1 |
| 正丁醇 | 0.80 | 微溶 | 117.2 |
| 正丁醚 | 0.77 | 不溶 | 142.0 |
| 乙酸正丁酯 | 0.90 | 微溶 | 126.5 |
合成:
方案甲:采用装置甲(分水器预先加入水,使水面略低于分水器的支管口),在干燥的50mL圆底烧瓶中,加入11.5mL(0.125mol)正丁醇和7.2mL(0.125mol)冰醋酸,再加入3~4滴浓硫酸和2g沸石,摇匀.按下图安装好带分水器的回流反应装置,通冷却水,圆底烧瓶在电热套上加热煮沸.在反应过程中,通过分水器下部的旋塞分出生成的水(注意保持分水器中水层液面仍保持原来高度,使油层尽量回到圆底烧瓶中).反应基本完成后,停止加热.
方案乙:采用装置乙,加料方式与方案甲相同.加热回流,反应60min后停止加热.

提纯:甲乙两方案均采用蒸馏方法.操作如下:

请回答:
(1)a处水流方向是进水(填“进水”或“出水”),仪器b的名称(直形)冷凝管.
(2)合成步骤中,方案甲监控酯化反应已基本完成的标志是分水器中水不再生成或分水器中的水层不再增加时.
(3)提纯过程中,步骤②是为了除去有机层中残留的酸,检验有机层已呈中性的操作是用玻璃棒蘸取有机层,点在pH试纸上,与标准比色卡对照,读取pH值判断;步骤③的目的是除去溶于酯中的少量无机盐.
(4)下列有关洗涤过程中分液漏斗的使用正确的是BC.
A.分液漏斗使用前必须要检漏,只要分液漏斗的旋塞芯处不漏水即可使用
B.洗涤时振摇放气操作应如图戊所示
C.放出下层液体时,需将玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔
D.洗涤完成后,先放出下层液体,然后继续从下口放出有机层置于干燥的锥形瓶中
(5)按装置丙蒸馏,最后圆底烧瓶中残留的液体主要是正丁醚;若按图丁放置温度计,则收集到的产品馏分中还含有正丁醇.
(6)实验结果表明方案甲的产率较高,原因是通过分水器及时分离出产物水,有利于酯化反应的进行,提高酯的产率.
14.下列关于卤化银的叙述中不正确的是( )
| A. | AgCl、AgBr、AgI均是难溶于水的固体,且要避光保存于棕色瓶中 | |
| B. | AgCl是白色难溶于水的固体,用于指纹鉴定有助于警察破案 | |
| C. | AgBr是黑色光敏性物质,常用于制作胶卷和人工降雨 | |
| D. | AgI是黄色固体,见光容易分解为单质碘和黑色的单质银,还常用于人工降雨 |
1.下列有关实验操作错误的是( )
| A. | 用加热的方法区分纯碱和小苏打 | |
| B. | 用量筒量取5.0mL浓硫酸,并直接加水稀释 | |
| C. | 用分液漏斗分离苯和水的混合物 | |
| D. | 用托盘天平称量药品时,左盘放物品,右盘放砝码 |
18.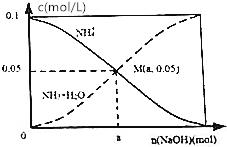 常温下,向1L 0.1mol•L-1NH4Cl溶液中,不断加入NaOH固体后,NH4+与NH3•H2O浓度的变化趋势如图所示(不考虑溶液体积变化和氨气的挥发),下列说法不正确的是( )
常温下,向1L 0.1mol•L-1NH4Cl溶液中,不断加入NaOH固体后,NH4+与NH3•H2O浓度的变化趋势如图所示(不考虑溶液体积变化和氨气的挥发),下列说法不正确的是( )
 常温下,向1L 0.1mol•L-1NH4Cl溶液中,不断加入NaOH固体后,NH4+与NH3•H2O浓度的变化趋势如图所示(不考虑溶液体积变化和氨气的挥发),下列说法不正确的是( )
常温下,向1L 0.1mol•L-1NH4Cl溶液中,不断加入NaOH固体后,NH4+与NH3•H2O浓度的变化趋势如图所示(不考虑溶液体积变化和氨气的挥发),下列说法不正确的是( )| A. | M点溶液中水的电离程度比原溶液小 | |
| B. | 在M点时,n(0H-)-n(H+)=(a-0.05)mol | |
| C. | 随着Na0H的加入,$\frac{c({H}^{+})}{c(N{{H}_{4}}^{+})}$不断减小 | |
| D. | 当n(NaOH)=0.1mol时,c(0H-)>c(C1-)>c(NH3•H20) |
5.下列反应的离子方程式正确的是( )
| A. | NaHCO3溶液中加入盐酸:CO32-+2H+═CO2↑+H2O | |
| B. | 紫色石蕊试液中滴入氢硫酸变红的原因是:H2S?2H++S2- | |
| C. | 等物质的量的MgCl2、Ba(OH)2和 HC1溶液混合:Mg2++2OH-═Mg(OH)2↓ | |
| D. | 铅酸蓄电池充电时的正极反应:PbSO4+2H2O-2e-═PbO2+4H++SO42- |