题目内容
2.在下列化学方程式中,不能用离子方程式:Ba2++SO42-═BaSO4↓ 来表示的是( )| A. | Ba(NO3)2+H2SO4═BaSO4↓+2HNO3 | B. | BaCl2+Na2SO4═BaSO4↓+2NaCl | ||
| C. | Ba(OH)2+K2SO4═BaSO4↓+2KOH | D. | Ba(OH)2+H2SO4═BaSO4↓+2H2O |
分析 Ba2++SO42-═BaSO4↓表示可溶性钡盐(或碱)与硫酸(或硫酸盐)反应生成硫酸钡和强酸(或可溶性盐)的离子反应,以此来解答.
解答 解:A、B、C的离子反应均为Ba2++SO42-═BaSO4↓,只有D中的离子反应为2H++2OH-+Ba2++SO42-═BaSO4↓+2H2O,
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应的离子反应考查,注意离子反应中保留化学式的物质,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气.对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用.
Ⅰ.脱硝:已知:H2的热值为142.9KJ•g-1
N2(g)+2O2(g)=2NO2(g)△H=+133kJ•mol-1
H2O(g)=H2O(l)△H=-44kJ•mol-1
催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1100.2kJ•mol-1.
Ⅱ.脱碳:向2L密闭容器中加入2mol CO2、6mol H2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g)?CH3OH(l)+H2O(l)
(1)①该反应自发进行的条件是低温(填“低温”、“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是de.
a、混合气体的平均式量保持不变 b、CO2和H2的体积分数保持不变
c、CO2和H2的转化率相等 d、混合气体的密度保持不变
e、1mol CO2生成的同时有3mol H-H键断裂
③CO2的浓度随时间(0~t2)变化如图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6CO2的浓度随时间的变化.

(2)改变温度,使反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0 中的所有物质都为气态.起始温度体积相同(T1℃、2L密闭容器).反应过程中部分数据见表:
①达到平衡时,反应I、II对比:平衡常数K(I)<K(II)(填“>”、“<”或“=”下同);平衡时CH3OH的浓度c(I)<c(II).
②对反应I,前10min内的平均反应速率v(CH3OH)=0.025mol•L-1•min-1,在其它条件不变下,若30min时只改变温度为T2℃,此时H2的物质的量为3.2mol,则T1<T2(填“>”、“<”或“=”).
若30min时只向容器中再充入1mol CO2(g)和1mol H2O(g),则平衡不移动(填“正向”、“逆向”或“不”).
Ⅰ.脱硝:已知:H2的热值为142.9KJ•g-1
N2(g)+2O2(g)=2NO2(g)△H=+133kJ•mol-1
H2O(g)=H2O(l)△H=-44kJ•mol-1
催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1100.2kJ•mol-1.
Ⅱ.脱碳:向2L密闭容器中加入2mol CO2、6mol H2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g)?CH3OH(l)+H2O(l)
(1)①该反应自发进行的条件是低温(填“低温”、“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是de.
a、混合气体的平均式量保持不变 b、CO2和H2的体积分数保持不变
c、CO2和H2的转化率相等 d、混合气体的密度保持不变
e、1mol CO2生成的同时有3mol H-H键断裂
③CO2的浓度随时间(0~t2)变化如图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6CO2的浓度随时间的变化.

(2)改变温度,使反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0 中的所有物质都为气态.起始温度体积相同(T1℃、2L密闭容器).反应过程中部分数据见表:
| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
| 反应I 恒温恒容 | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 | ||||
| 反应II 绝热恒容 | 0min | 0 | 0 | 2 | 2 |
②对反应I,前10min内的平均反应速率v(CH3OH)=0.025mol•L-1•min-1,在其它条件不变下,若30min时只改变温度为T2℃,此时H2的物质的量为3.2mol,则T1<T2(填“>”、“<”或“=”).
若30min时只向容器中再充入1mol CO2(g)和1mol H2O(g),则平衡不移动(填“正向”、“逆向”或“不”).
10.铜锌原电池(如图)工作时,下列叙述不正确的是( )
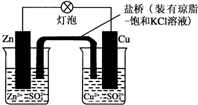

| A. | 负极反应为:Zn-2e-═Zn2+ | B. | 电池反应为:Zn+Cu2+═Zn2++Cu | ||
| C. | 在外电路中,电子从负极流向正极 | D. | 盐桥中的K+移向ZnSO4溶液 |
17.下列物质中,不能与SiO2反应的是( )
| A. | NaOH | B. | CaO | C. | 氢氟酸 | D. | H2O |
14.下列物质中,摩尔质量最大的是( )
| A. | 10mL H2O | B. | 0.8mol H2SO4 | C. | 54g Al | D. | 1gCaCO3 |
11.下列热化学方程式正确的是(△H的绝对值均正确)( )
| A. | 表示H2燃烧热:2H2(g)+O2(g)═2H2O1)△H=-571.6 kJ/mol | |
| B. | 表示中和热:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(1)△H=+57.3 kJ/mol | |
| C. | 表示反应热:4Al(s)+3O2(g)═2Al2O3(S)△H=-3352kJ/mol | |
| D. | 表示石墨比金刚石稳定:C(石墨)=C(金刚石)△H=-1.9 kJ/mol |
12.以CO(g)和H2(g)为原料合成甲醇反应及其能量变化如图所示,下列判断错误的是( )
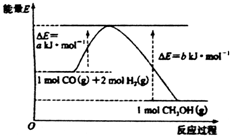

| A. | 该反应的活化能为a kJ•mol-1 | |
| B. | 1mol CO(g)和2 mol H2(g)的能量和大于1mol CH3OH(g)的能量 | |
| C. | 该反应的热化学方程式为:CO(g)+2H2(g)=CH3OH(g)△H=(a-b)kJ•mol-1 | |
| D. | CO(g)+2H2(g)=CH3OH(1)△H=c kJ•mol-1c>(a-b) |