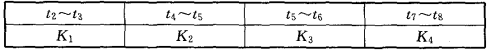
题目内容
7.如图所示是用铅蓄电池为电源,模拟氯碱工业中电解饱和食盐水的装置图(C、D均为石墨电极).已知铅蓄电池在放电时发生下列电极反应.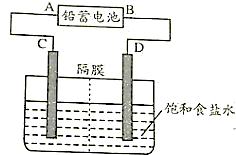
负极:Pb+SO42--2e-═PbSO4
正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O
(1)若在电解池中C极一侧滴2滴酚酞试液、电解一段时间后,未呈红色,说明该铅蓄电池的A极为正极
(2)用铅蓄电池电解2L饱和食盐水(食盐水足量,密度为1.15g/cm3)时:
①若收集到11.2L(标准状况下)氯气,则至少转移电子1mol.
②若该电池消耗0.02molH2SO4,则可收集到H2的体积为0.224(标准状况下)L.电解后除去隔膜,所得溶液在常温下的pH为12(假定氯气全部排出,电解过程中溶液体积的变化忽略不计).
分析 (1)电解池中C极一侧滴2滴酚酞试液、电解一段时间后,未呈红色说明C电极为阳极,电源A为正极;
(2)①依据电解氯化钠生成氯气电极反应计算转移电子物质的量;
②依据铅蓄电池和电解池中电子转移守恒计算生成氢气的物质的量及体积;根据反应2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑计算出反应后氢氧化钠溶液的浓度及溶液的pH.
解答 解:(1)电解池中C极一侧滴2滴酚酞试液、电解一段时间后,未呈红色说明C电极为阳极,D为阴极,电源A为正极,
故答案为:正极;
(2)①电解饱和食盐水生成氯气的电极反应为:2Cl--2e-=Cl2↑,收集到11.2L(标准状况下)氯气物质的量为:$\frac{11.2L}{22.4L/mol}$=0.5mol,转移电子物质的量为:0.5mol×2=1mol,
故答案为:1;
②蓄电池消耗H2SO4 0.02mol,依据电极反应PbO2+4H++SO42-+2e-=PbSO4+2H2O,消耗0.02mol硫酸电子转移0.02mol,电解食盐水阴极电极反应为2H++2e-=H2↑,则转移0.02mol电子生成氢气的物质的量为0.01mol,标准状况体积为:22.4L/mol×0.01mol=0.224;
根据反应2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑可知生成0.01mol氢气时会同时生成0.02molNaOH,氢氧根离子的浓度为:$\frac{0.02mol}{2L}$=0.01mol/L,则所得溶液的pH=12,
故答案为:0.224L;12.
点评 本题考查了原电池、电解池工作原理,题目难度中等,注意掌握电解池和原电池工作原理,明确电极反应的书写方法及电子守恒在化学计算中的应用方法,试题培养了学生的分析能力及灵活应用能力.

 名校课堂系列答案
名校课堂系列答案| A. | 加入硝酸银溶液时有白色沉淀产生 | |
| B. | 加入盐酸时有无色无味气体产生,该气体能使澄清石灰水变浑浊 | |
| C. | 加入氯化钙溶液时有白色沉淀产生,再加稀盐酸沉淀溶解,且产生可使澄清石灰水变浑浊的无色无味气体 | |
| D. | 加入氢氧化钡溶液时有白色沉淀,再加稀盐酸反应现象如C |
| A. | S-H…O | B. | N-H…N | C. | F-H…F | D. | C-H…N |
 (1,3-环己二烯)的各步反应方程式
(1,3-环己二烯)的各步反应方程式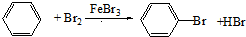
 +3H2$\stackrel{一定条件下}{→}$
+3H2$\stackrel{一定条件下}{→}$
 +H2O+NaBr
+H2O+NaBr
 增大。
增大。