题目内容
14.标准状况下,0.5molCl2的体积为11.2L,其质量为35.5 g.分析 根据V=nVm计算出标况下0.5molCl2的体积,再根据m=nM计算出氯气的质量.
解答 解:标准状况下,0.5molCl2的体积为:22.4L/mol×0.5mol=11.2L,其质量为:71g/mol×0.5mol=35.5g,
故答案为:11.2;35.5.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与气体摩尔体积、摩尔质量之间的关系即可解答,试题侧重据此知识点的考查,有利于提高学生的化学计算能力.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
2.将相同质量的铜分别和过量浓硝酸、稀硝酸反应,下列叙述不正确的是( )
| A. | 反应速率:前者快,后者慢 | |
| B. | 消耗硝酸的物质的量:前者多,后者少 | |
| C. | 反应生成相同条件下气体的体积:前者多,后者少 | |
| D. | 反应中转移的电子总数:前者多,后者少 |
9.下列各组物质中,不能按图示关系一步完成转化的是( )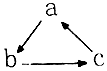

| A | B | C | D | |
| a | CO2 | Al(OH)3 | H2SO4 | HNO3 |
| b | Na2CO3 | NaAlO2 | SO2 | NO |
| c | NaHCO3 | Al2O3 | SO3 | NO2 |
| A. | A | B. | B | C. | C | D. | D |
19.下列表示对应化学反应的离子方程式正确的是( )
| A. | 向Al2(SO4)3溶液中加入过量NH3•H2O:Al3++4NH3•H2O═-+4NH4+ | |
| B. | 铅酸蓄电池充电时的正极反应:PbO2+4H++SO42-+2e-═PbSO4+2H2O | |
| C. | Fe2(SO4)3溶液与Ba(OH)2溶液反应:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ | |
| D. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应:2NH4++Fe2++4OH-═Fe(OH)2↓+2NH3•H2O |
2.下列各种制备物质的方案中,不正确的( )
| A. | 电解饱和食盐水制金属钠 | B. | 电解熔融氯化镁制金属镁 | ||
| C. | 氧化铁与一氧化碳高温反应炼铁 | D. | 焦炭高温还原二氧化硅制粗硅 |
1.下列物质长期暴露在空气中质量增加且变质的是( )
(1)浓硫酸(2)浓盐酸(3)粗盐(4)生石灰(5)氢氢化钠(6)酒精.
(1)浓硫酸(2)浓盐酸(3)粗盐(4)生石灰(5)氢氢化钠(6)酒精.
| A. | (1)(2)(3) | B. | (4)(5) | C. | (1)(2)(5) | D. | 全部 |
 A、B、C、D、E五种元素的原子序数依次增大.A是原子半价最小的元素;B的最外层电子数是次外层电子数的2倍; D的L能层有两对成对电子;E+的核外有三个能层,且都外于全满状态.试回答下列问题:
A、B、C、D、E五种元素的原子序数依次增大.A是原子半价最小的元素;B的最外层电子数是次外层电子数的2倍; D的L能层有两对成对电子;E+的核外有三个能层,且都外于全满状态.试回答下列问题: