题目内容
14.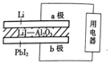 某锂碘电池以LiI-Al2O3固体为电解质传递离子,其基本结构示意图如下,电池总反应可表示为:2Li+PbI2═2LiI+Pb,下列说法正确的是( )
某锂碘电池以LiI-Al2O3固体为电解质传递离子,其基本结构示意图如下,电池总反应可表示为:2Li+PbI2═2LiI+Pb,下列说法正确的是( )| A. | 电子由b极经用电器流向a极 | |
| B. | I-由a极通过固体电解质传递到b极 | |
| C. | b极上的电极反应式为:PbI2+2e-═Pb+2I- | |
| D. | b极质量减少1.27g时,a极转移的电子数约为6.02×1021 |
分析 由电池总反应可表示为:2Li+PbI2═2LiI+Pb,可知锂为电池的负极,发生氧化反应,PbI2为电池的正极,发生还原反应,PbI2+2e-=Pb+2I-电池工作时,电子通过外电路从负极流向正极,即从a极流向b极,电解质溶液中阴离子向负极移动,即由b极通过固体酸电解质传递到a极;由反应PbI2+2e-=Pb+2I-,b极质量减少1.27g时,转移0.01mol电子,以此来解答.
解答 解:A.由电池反应可知,Li失去电子,则锂为电池的负极,PbI2为电池的正极,电子应该是通过外电路由a极流向b,故A错误;
B.电解质溶液中阴离子向负极移动,即由b极通过固体酸电解质传递到a极,故B错误;
C.PbI2为电池的正极,发生还原反应,PbI2+2e-=Pb+2I-,故C错误;
D.由反应PbI2+2e-=Pb+2I-,b极质量减少1.27g时,转移0.01mol电子,a极转移的电子数约为6.02×1021,故D正确.
故选D.
点评 本题考查原电池原理及应用,为高频考点,把握电极、电极反应及原电池中电子荷离子的移动为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
11.喀斯特地貌地区蕴藏了大量石灰石.下列材料与石灰石主要成分相同的是( )
| A. | 玻璃 | B. | 水泥 | C. | 陶瓷 | D. | 大理石 |
9.在短周期主族元素中,甲元素与乙、丙、丁三元素相邻,甲、乙的原子序数之和等于丙的原子序数,这四种元素原子的最外层电子数之和为20.下列判断中正确的是( )
| A. | 四种元素中,甲的最高价氧化物对应水化物的酸性最强 | |
| B. | 四种元素中,丙的气态氢化物最稳定 | |
| C. | 乙在自然界中形成的化合物种类最多 | |
| D. | 丁和甲、乙、丙都只能形成一种共价化合物 |
19.用下列实验装置进行相应实验,能达到实验目的是( )

| A. | 用图1所示装置从KI和I2的固体混合物中回收I2 | |
| B. | 用图2所示装置配制100mL0.10mol•L-1 K2Cr2O7溶液 | |
| C. | 用图3所示装置干燥少量的SO2的气体 | |
| D. | 用图4所示装置蒸干FeCl3饱和溶液制备FeCl3晶体 |
6.下列实验对应的现象与结论均正确的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 将浓硫酸滴入蔗糖中 | 固体变黑后发生膨胀 | 浓硫酸具有吸水性和强还原性 |
| B | 将两粒相同的钠分别投入乙醇和水中 | 固体在水中反应比在乙醇中剧烈 | 相同条件下,水的电离能力比乙醇强 |
| C | 向某溶液中滴加氯水后再滴入KSCN溶液 | 溶液变为红色溶液变为红色 | 该溶液中一定含有Fe3+ |
| D | 常温时将铝片加入浓硝酸中 | 未出现气泡 | 常温下铝与浓硝酸不反应 |
| A. | A | B. | B | C. | C | D. | D |
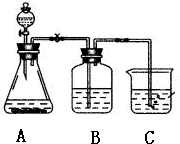 某学习小组同学为了确定盐酸、苯酚、碳酸的酸性强弱,设计了如图所示的装置图进行实验:
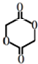
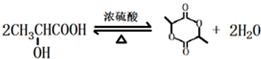
某学习小组同学为了确定盐酸、苯酚、碳酸的酸性强弱,设计了如图所示的装置图进行实验: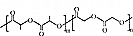 )制成的外科手术缝线在人体内可降解,省去了缝合皮肤后拆线的麻烦,合成PLGA的一种路线如图:
)制成的外科手术缝线在人体内可降解,省去了缝合皮肤后拆线的麻烦,合成PLGA的一种路线如图: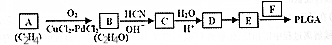
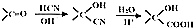
 ;
; ;
;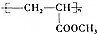 的合成线路:
的合成线路: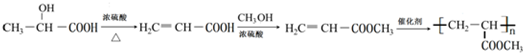 .
.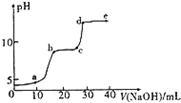 某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.
某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.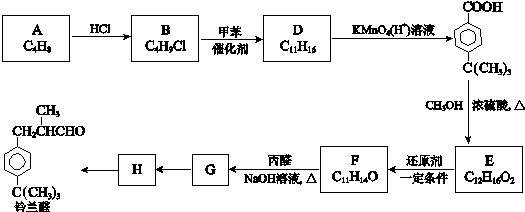
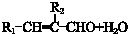
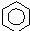 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$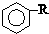 +HCl
+HCl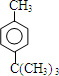 .
.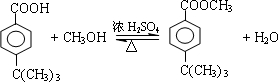 .
. .
. .
. .
.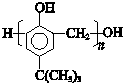 ,合成路线是(不需写化学方程式)
,合成路线是(不需写化学方程式)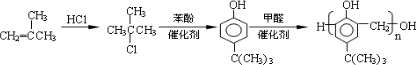 .
.