题目内容
标准状况时,将21g过氧化钠与铝粉混合物加入100mL水中,充分反应混合物完全溶解,并收集到5.6L气体.计算
:
(1)收集到气体的组成.
(2)若反应后溶液体积仍为100mL,计算反应后溶液中Na+和OH-的物质的量浓度.
:
(1)收集到气体的组成.
(2)若反应后溶液体积仍为100mL,计算反应后溶液中Na+和OH-的物质的量浓度.
考点:有关混合物反应的计算,化学方程式的有关计算
专题:计算题
分析:发生反应有:2Na2O2+2H2O=4NaOH+O2↑、2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
(1)生成的气体为氧气与氢气,过氧化钠与Al都完全反应,设过氧化钠与Al的物质的量分别为x mol、y mol,根据二者质量之和及生成气体的体积之和列方程计算;
(2)结合方程式计算判断NaOH是否完全反应、生成偏铝酸钠的物质的量,确定NaOH物质的量,再根据c=
计算反应后溶液中Na+和OH-的物质的量浓度.
(1)生成的气体为氧气与氢气,过氧化钠与Al都完全反应,设过氧化钠与Al的物质的量分别为x mol、y mol,根据二者质量之和及生成气体的体积之和列方程计算;
(2)结合方程式计算判断NaOH是否完全反应、生成偏铝酸钠的物质的量,确定NaOH物质的量,再根据c=
| n |
| V |
解答:
解:(1)发生反应有:2Na2O2+2H2O=4NaOH+O2↑、2Al+2NaOH+2H2O=2NaAlO2+3H2↑,生成的气体为氧气与氢气的混合物,
设过氧化钠与Al的物质的量分别为x、y,过氧化钠与Al都反应,则:
2Na2O2+2H2O=4NaOH+O2↑,
x 2x 0.5x
2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
y y y 1.5y
则:78x+27y=21、0.5x+1.5y=
=0.25mol,
解得:x=0.24mol、y=0.087mol,
所以混合气体中氧气的物质的量为:0.5x=0.12mol,标况下体积为:22.4L/mol×0.12mol=2.68L,
生成氢气的物质的量为:1.5y=0.1305mol,标况下生成氢气的体积为:22.4L/mol×0.1305mol=2.92L,
答:收集到气体为2.68L氧气、2.92L氢气;
(2)由方程式可知,过氧化钠反应生成氢氧化钠为:2×0.24mol=0.48mol,
Al反应消耗的NaOH为0.087mol、生成的偏铝酸钠为0.087mol,
故溶液中剩余氢氧化钠的物质的量为:0.48mol-0.087mol=0.393mol,
溶液中Na+的物质的量浓:
=4.8mol/L;
OH-的物质的量浓度为:
=3.93mol/L,
答:反应后溶液中Na+和OH-的物质的量浓度分别为4.8mol/L、3.93mol/L.
设过氧化钠与Al的物质的量分别为x、y,过氧化钠与Al都反应,则:
2Na2O2+2H2O=4NaOH+O2↑,
x 2x 0.5x
2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
y y y 1.5y
则:78x+27y=21、0.5x+1.5y=
| 5.6L |
| 22.4L/mol |
解得:x=0.24mol、y=0.087mol,
所以混合气体中氧气的物质的量为:0.5x=0.12mol,标况下体积为:22.4L/mol×0.12mol=2.68L,
生成氢气的物质的量为:1.5y=0.1305mol,标况下生成氢气的体积为:22.4L/mol×0.1305mol=2.92L,
答:收集到气体为2.68L氧气、2.92L氢气;
(2)由方程式可知,过氧化钠反应生成氢氧化钠为:2×0.24mol=0.48mol,
Al反应消耗的NaOH为0.087mol、生成的偏铝酸钠为0.087mol,
故溶液中剩余氢氧化钠的物质的量为:0.48mol-0.087mol=0.393mol,
溶液中Na+的物质的量浓:
| 0.48mol |
| 0.1L |
OH-的物质的量浓度为:
| 0.393mol |
| 0.1L |
答:反应后溶液中Na+和OH-的物质的量浓度分别为4.8mol/L、3.93mol/L.
点评:本题考查混合物反应的有关计算,为高频考点,题目难度中等,注意题目中反应物全部反应,明确反应实质为解答关键,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
下列事实一定能证明HNO2是弱电解质的是( )
①常温下HNO2溶液的pH小于7
②用HNO2溶液做导电实验,灯泡很暗
③HNO2和NaCl不能发生反应
④0.1mol/L HNO2溶液的pH=2.1
⑤NaNO2和H3PO4反应,生成HNO2
⑥pH=1的HNO2溶液稀释至100倍,pH约为2.8
⑦常温下NaNO2溶液的pH大于7.
①常温下HNO2溶液的pH小于7
②用HNO2溶液做导电实验,灯泡很暗
③HNO2和NaCl不能发生反应
④0.1mol/L HNO2溶液的pH=2.1
⑤NaNO2和H3PO4反应,生成HNO2
⑥pH=1的HNO2溶液稀释至100倍,pH约为2.8
⑦常温下NaNO2溶液的pH大于7.
| A、①④⑥ | B、①②③④ |
| C、④⑤⑥⑦ | D、全部 |
若某基态原子的外围电子排布为4d15s2,则下列说法错误的是( )
| A、该元素位于第5周期,ⅢB族 |
| B、该元素原子核外有5个电子层 |
| C、该元素原子最外层共有3个电子 |
| D、该元素原子M能层共有18个电子 |
绿色农药--信息素的推广使用,对环保有重要意义.有一种信息素的结构简式为CH3(CH2)5CH=CH(CH2)9CHO.下列关于检验该信息素中官能团的试剂和顺序正确的是( )
| A、先加入酸性高锰酸钾溶液,后加银氨溶液,微热 |
| B、先加入溴水,后加酸性高锰酸钾溶液 |
| C、先加入新制氢氧化铜悬浊液,加热,调PH至酸性再加入溴水 |
| D、先加入银氨溶液,再另取该物质加入溴水 |
下列有关油脂的叙述错误的是( )
| A、植物油能使溴水褪色 |
| B、皂化反应是指油脂在碱性条件下的水解过程 |
| C、硬水使肥皂的去污能力减弱是因为发生了沉淀反应 |
| D、油脂的水解反应称皂化反应 |
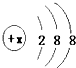 所示,该微粒氧化性甚弱,但得到电子后还原性强,且这种原子有一个单电子,这种微粒的符号是
所示,该微粒氧化性甚弱,但得到电子后还原性强,且这种原子有一个单电子,这种微粒的符号是
 )做还原剂还原氮氧化合物是目前处理汽车尾气的一种方法,现设计实验模拟该过程并检验或收集其反应产物.
)做还原剂还原氮氧化合物是目前处理汽车尾气的一种方法,现设计实验模拟该过程并检验或收集其反应产物.