题目内容
下列事实一定能证明HNO2是弱电解质的是( )
①常温下HNO2溶液的pH小于7
②用HNO2溶液做导电实验,灯泡很暗
③HNO2和NaCl不能发生反应
④0.1mol/L HNO2溶液的pH=2.1
⑤NaNO2和H3PO4反应,生成HNO2
⑥pH=1的HNO2溶液稀释至100倍,pH约为2.8
⑦常温下NaNO2溶液的pH大于7.
①常温下HNO2溶液的pH小于7
②用HNO2溶液做导电实验,灯泡很暗
③HNO2和NaCl不能发生反应
④0.1mol/L HNO2溶液的pH=2.1
⑤NaNO2和H3PO4反应,生成HNO2
⑥pH=1的HNO2溶液稀释至100倍,pH约为2.8
⑦常温下NaNO2溶液的pH大于7.
| A、①④⑥ | B、①②③④ |
| C、④⑤⑥⑦ | D、全部 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:部分电离、溶液中存在电离平衡的电解质为弱电解质,利用酸不能完全电离或盐类水解的规律来分析HNO2是弱电解质.
解答:
解:①常温下HNO2溶液的pH小于7,只能证明其为酸,不能证明其为弱酸,故①错误;
②溶液的导电性与离子浓度成正比,用HNO2溶液做导电实验,灯泡很暗,只能说明溶液中离子浓度很小,不能说明亚硝酸的电离程度,所以不能证明亚硝酸为弱电解质,故②错误;
③HNO2和NaCl不能发生反应,只能说明不符合复分解反应的条件,但不能说明是弱酸,故③错误;
④常温下0.1 mol?L-1 HNO2溶液的pH=2.1,说明亚硝酸不完全电离,溶液中存在电离平衡,所以能说明亚硝酸为弱酸,故④正确;
⑤强酸可以制取弱酸,NaNO2和H3PO4反应,生成HNO2,说明HNO2的酸性弱于H3PO4,所以能说明亚硝酸为弱酸,故⑤正确;
⑥常温下pH=1的HNO2溶液稀释至100倍,pH约为2.8说明亚硝酸中存在电离平衡,则亚硝酸为弱电解质,故⑥正确;
⑦常温下亚硝酸钠溶液的pH大于7,说明亚硝酸钠为强碱弱酸盐,所以能说明亚硝酸为弱酸,故⑦正确;
故选C.
②溶液的导电性与离子浓度成正比,用HNO2溶液做导电实验,灯泡很暗,只能说明溶液中离子浓度很小,不能说明亚硝酸的电离程度,所以不能证明亚硝酸为弱电解质,故②错误;
③HNO2和NaCl不能发生反应,只能说明不符合复分解反应的条件,但不能说明是弱酸,故③错误;
④常温下0.1 mol?L-1 HNO2溶液的pH=2.1,说明亚硝酸不完全电离,溶液中存在电离平衡,所以能说明亚硝酸为弱酸,故④正确;
⑤强酸可以制取弱酸,NaNO2和H3PO4反应,生成HNO2,说明HNO2的酸性弱于H3PO4,所以能说明亚硝酸为弱酸,故⑤正确;
⑥常温下pH=1的HNO2溶液稀释至100倍,pH约为2.8说明亚硝酸中存在电离平衡,则亚硝酸为弱电解质,故⑥正确;
⑦常温下亚硝酸钠溶液的pH大于7,说明亚硝酸钠为强碱弱酸盐,所以能说明亚硝酸为弱酸,故⑦正确;
故选C.
点评:本题考查弱电解质的判断,明确弱电解质的性质是解答本题的关键,常用的方法是利用电离的不完全性、测定盐溶液的pH、做对比实验等来判断弱电解质.

练习册系列答案
相关题目
下列应用或事实与胶体的性质无关的是( )
| A、用明矾净化饮用水 |
| B、用石膏或盐卤制豆腐 |
| C、向FeCl3溶液中滴加NaOH溶液出现红褐色沉淀 |
| D、阳光透过墙上的小孔在较暗的房间里形成一道道光柱 |
向1000mL某稀硝酸中加入5.6g铁粉,充分反应后,铁粉完全溶解并放出NO气体,溶液质量增加3.4g.则下列结论正确的是( )
| A、反应后的溶液中不含Fe2+ |
| B、放出的NO气体的体积在标准状况为2.24L |
| C、稀硝酸的物质的量浓度为0.2mol?L-1 |
| D、所得溶液中Fe2+和Fe3+的物质的量之比为4:1 |
氯和钾与不同价态的铜可生成两种化合物,这两种化合物都可用于催化乙炔聚合,其阴离子均为无限长链结构(如图),a位置上Cl原子的杂化轨道类型为( )
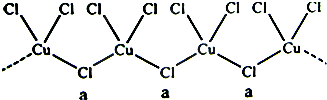

| A、sp杂化 |
| B、sp2杂化 |
| C、sp3杂化 |
| D、dsp2杂化 |
 (1)稀释0.1mol?L-1氨水时,随着水量的增加而减小的是
(1)稀释0.1mol?L-1氨水时,随着水量的增加而减小的是 氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:(图中涉及物质为气态)
氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:(图中涉及物质为气态)