题目内容
17.(1)NH4NO3是强酸弱碱形成的盐,其水溶液呈酸 性,CH3COONa强碱弱酸形成的盐,其水溶液呈碱 性.(2)CH3COONa发生水解时的离子方程式H2O+CH3COO-?CH3COOH+OH-
(3)NH4NO3发生水解时的离子方程式NH4++H2O?NH3•H2O+H+.
分析 (1)铵根离子水解显酸性,醋酸根离子水解显碱性;
(2)醋酸根离子水解生成醋酸和氢氧根离子;
(3)铵根离子水解生成一水合氨和氢离子.
解答 解:(1)由盐类水解规律可知,NH4NO3是强酸弱碱形成的盐,其水溶液呈酸性,CH3COONa强碱弱酸形成的盐,其水溶液呈碱性,
故答案为:酸;碱;
(2)CH3COONa发生水解时的离子方程式为H2O+CH3COO-?CH3COOH+OH-,故答案为:H2O+CH3COO-?CH3COOH+OH-;
(3)NH4NO3发生水解时的离子方程式为NH4++H2O?NH3•H2O+H+,故答案为:NH4++H2O?NH3•H2O+H+.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重水解反应的离子反应考查,注意离子反应中保留化学式的物质及电荷守恒,题目难度不大.

练习册系列答案
 培优三好生系列答案
培优三好生系列答案
相关题目
8.下列气体不能用来做喷泉实验的是( )
| A. | HCl | B. | NO | C. | SO2 | D. | NH3 |
5.用NA表示阿伏加德罗常数的值.下列叙述中不正确的是( )
| A. | 12.5mL 16mol•L-1浓硫酸与足量锌反应,转移电子数为0.2NA | |
| B. | 1.8gNH4+与2.3gNa+所含电子数目均为NA | |
| C. | 7.8 gNa2S固体和7.8 gNa2O2固体中含有的阴离子数目均为0.1 NA | |
| D. | 常温常压下,92 gNO2和N2O4混合气体含有的原子数为6NA |
12.除去铁粉中的少量铝粉,可以选用下列哪种溶液( )
| A. | 盐酸 | B. | 硝酸 | C. | 硫酸 | D. | 氢氧化钠溶液 |
2.一定温度下,在容积固定的密闭容器中,反应2SO2(g)+O2(g)?2SO3(g)达到平衡后,再通人气体18O2,重新达到平衡,下列说法不正确的是( )
| A. | 平衡向正反应方向移动 | |
| B. | 前后两次平衡后,容器内的压强不相等次是相等 | |
| C. | SO2、O2的转化率均增大 | |
| D. | 通18O2前、通18O2后、重新到平衡后三个时间段,v(正)与v(逆)的关系依次是相等、大于、相等 |
9.25℃时,某一元强碱溶液的pH为a,某一元酸HA溶液的pH为b,电离度为1.0%,若将1体积的此强碱溶液与10体积的HA溶液混合,恰好完全反应,则a与b之和为( )
| A. | 14 | B. | 15 | C. | 16 | D. | 17 |
6.下列说法正确的是( )
| A. | 淀粉和纤维素都是纯净物 | |
| B. | 油脂不是高分子化合物 | |
| C. | 植物油不能使溴的四氯化碳溶液褪色 | |
| D. | 糖类物质均有甜味 |
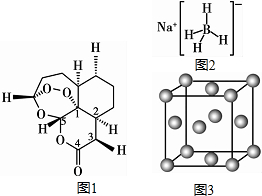 现有H、C、B、0、N、Na、Cu等七种元素,可形成多种物质.2015年10月中国药学家屠呦呦因发现青蒿素(含H、C、O元素)而获得诺贝尔生理医学奖,青蒿素( C15H22O5)的结构
现有H、C、B、0、N、Na、Cu等七种元素,可形成多种物质.2015年10月中国药学家屠呦呦因发现青蒿素(含H、C、O元素)而获得诺贝尔生理医学奖,青蒿素( C15H22O5)的结构