题目内容
6.下列说法正确的是( )| A. | 淀粉和纤维素都是纯净物 | |
| B. | 油脂不是高分子化合物 | |
| C. | 植物油不能使溴的四氯化碳溶液褪色 | |
| D. | 糖类物质均有甜味 |
分析 A.淀粉、纤维素都是有机高分子,都是混合物;
B.高分子化合物相对分子质量特别大一般达1万以上、一般具有重复结构单元;
C.植物油中含有不饱和的碳碳双键;
D.糖类不一定有甜味.
解答 解:A.它们的通式都是(C6H10O5)n,但聚合物的n不同个体数不确定,长短不一定,也就是说淀粉、纤维素都分别是由长短不一的聚合物混合在一起的,所以都是混合物,故A错误;
B.油脂相对分子质量较小,不属于高分子化合物,故B正确;
C.植物油中含有不饱和的碳碳双键,能与溴发生加成反应,使溴的四氯化碳溶液褪色,故C错误;
D.糖类不一定有甜味如多糖,故D错误;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握常见有机物的组成、官能团与性质的关系等为解答的关键,注重糖类、油脂基础知识的考查,题目难度不大.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案
相关题目
16.用NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 标准状况下,22.4L己烷分子数约为NA | |
| B. | 1 mol甲基含10 NA个电子 | |
| C. | 在人体内,180g葡萄糖完全被生理氧化所消耗的氧气的分子数为6NA | |
| D. | 0.5mol 1,3-丁二烯(CH2=CHCH=CH2)分子中含有碳碳双键数为2NA |
14.第ⅢA族R元素在地壳中的丰度约为0.001%,单质熔点2180℃,原子半径小于铍,则关于R的叙述不正确的是( )
| A. | 是非金属元素 | B. | 单质是分子晶体 | ||
| C. | R(OH)4-结合H+的能力小于Al(OH)4- | D. | R2H6中R为-3价 |
1.研究小组为探究弱酸性条件下铁发生电化学腐类型的影响因素,将2.0g新制铁粉和0.5g碳粉混合均匀并置于锥形瓶底部,塞上瓶塞(如图1).从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化.
实验测得容器中压强随时间变化如图2,.则下列说法不正确的是( )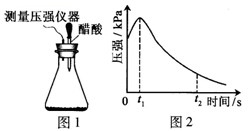
实验测得容器中压强随时间变化如图2,.则下列说法不正确的是( )

| A. | t2时容器中压强明显小于起始压强原因是铁发生了吸氧腐蚀 | |
| B. | 0~t2时压强变大的原因可能是铁发生了析氢腐蚀 | |
| C. | 0~t1时压强变大的原因可能是腐蚀过程为放热反应,锥形瓶内气体温度升高 | |
| D. | 钢铁在酸性条件下一定发生析氢腐蚀 |
8.自从1902年德国化学家哈伯研究出合成氨的方法以来,氮的固定的相关研究获得了不断的发展.
(1)分析下表数据可知:大气固氮反应属于吸热(填“吸热”或“放热”)反应.2260℃时,向2L密闭容器中充入0.3molN2和0.3molO2,模拟大气固氮反应,达到平衡时,N2的转化率是33.3%(结果保留三位有效数字).
(2)工业固氮的主要形式是:N2 (g)+3H2 (g)?2NH3 (g)△H<0,如图是当反应器中按n(N2):n(H2)=1:3 投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线.
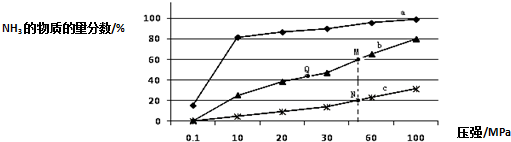
①曲线a对应的温度是200℃.
②关于工业合成氨的反应,下列叙述正确的是A(填字母).
A.图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N)
B.工业合成氨之所以加入催化剂,是因为加入催化剂有利于提高反应的活化能
C.相同压强下,投料相同,达到平衡所需时间关系为c>b>a
③N点时c(NH3)=0.2mol/L,N点的化学平衡常数K=0.93(结果保留两位小数).
(3)合成氨原料气中的氢气可用天然气(主要成分为CH4)在高温、催化剂作用下与水蒸气反应制得,反应中每生成2mol CO2吸收316kJ热量,该反应的热化学方程式是CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+158kJ/mol,该方法制得的原料气中主要杂质是CO2,若用K2CO3溶液吸收,该反应的离子方程式是CO32-+CO2+H2O=2HCO3-.
(4)合成氨工业中含氨废水的处理方法之一是电化学氧化法,将含氨的碱性废水通入电解系统后,在阳极上氨被氧化成氮气而脱除,阳极的电极反应式为2NH3-6e-+6OH-=N2+6H2O.
(1)分析下表数据可知:大气固氮反应属于吸热(填“吸热”或“放热”)反应.2260℃时,向2L密闭容器中充入0.3molN2和0.3molO2,模拟大气固氮反应,达到平衡时,N2的转化率是33.3%(结果保留三位有效数字).
| 反应 | 大气固氮N2(g)+O2(g)?2NO(g) | |
| 温度/℃ | 27 | 2260 |
| K | 3.84×10-31 | 1 |

①曲线a对应的温度是200℃.
②关于工业合成氨的反应,下列叙述正确的是A(填字母).
A.图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N)
B.工业合成氨之所以加入催化剂,是因为加入催化剂有利于提高反应的活化能
C.相同压强下,投料相同,达到平衡所需时间关系为c>b>a
③N点时c(NH3)=0.2mol/L,N点的化学平衡常数K=0.93(结果保留两位小数).
(3)合成氨原料气中的氢气可用天然气(主要成分为CH4)在高温、催化剂作用下与水蒸气反应制得,反应中每生成2mol CO2吸收316kJ热量,该反应的热化学方程式是CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+158kJ/mol,该方法制得的原料气中主要杂质是CO2,若用K2CO3溶液吸收,该反应的离子方程式是CO32-+CO2+H2O=2HCO3-.
(4)合成氨工业中含氨废水的处理方法之一是电化学氧化法,将含氨的碱性废水通入电解系统后,在阳极上氨被氧化成氮气而脱除,阳极的电极反应式为2NH3-6e-+6OH-=N2+6H2O.

 ;④HCHO等,其中碳原子采取sp2杂化的分子有①③④(填序号);HCHO分子的空间构型为平面三角形.
;④HCHO等,其中碳原子采取sp2杂化的分子有①③④(填序号);HCHO分子的空间构型为平面三角形.