题目内容
14.下列各组化合物中,均能由单质直接化合而得到的是( )| A. | NH3、CuS、SO2、FeS | B. | SO3、Cu2S、FeI2、FeCl3 | ||
| C. | FeCl3、SO2、NO、Cu2S | D. | FeCl2、FeS、SO2、FeI3 |
分析 A.铜和硫化合生成的是硫化亚铜,不是硫化铜;
B.硫在氧气中燃烧生成是二氧化硫,不是三氧化硫;
C.四种化合物都可以由单质通过化合反应得到;
D.Fe和氯气反应生成的是FeCl3,铁与碘单质反应生成的FeI2,不会得到FeI3.
解答 解:A.NH3、SO2、FeS可以由单质通过化合反应生成,而单质Cu、S发生化合反应生成的是Cu2S,故A错误;
B.SO3、Cu2S、FeI2、FeCl3可以由单质通过化合反应生成,而S和氧气反应生成的是SO2,故B错误;
C.FeCl3、SO2、NO、Cu2S都可以由单质通过化合反应生成,满足条件,故C正确;
D.FeS、SO2可以由单质通过化合反应生成,而Fe和I2反应生成的是FeI2,Fe和氯气反应生成的是FeCl3,故D错误;
故选C.
点评 本题考查了常见金属元素单质及其化合物性质,题目难度中等,明确常见金属单质及其化合物的性质为解答关键,注意Fe与S、I2单质反应生成的分别为FeS、FeI2,试题有利于培养学生的灵活应用能力.

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
9.在500mL1.0mol•L-1的CuSO4溶液中,阳极为100gCu片,阴极为100gZn片,通电一段时间后,立即取出电极,测得Zn片质量变为106.4g,此时剩余溶液中CuSO4的物质的量浓度为( )
| A. | 0.25mol•L-1 | B. | 0.8mol•L-1 | C. | 1.0mol•L-1 | D. | 1.2mol•L-1 |
6. 水是人类宝贵的自然资源,也是一种重要的化工原料.如图是电解水原理的实验装置图.
水是人类宝贵的自然资源,也是一种重要的化工原料.如图是电解水原理的实验装置图.
(1)写出电解水的化学方程式,若为氧化还原反应,请用双线桥表示出电子的转移方向和数目.
 .
.
(2)假设电解了3.6gH2O,请完成下表.
(3)若在47.8gH2O(过量)中加入2.3gNa.钠与水反应的离子方程式为2Na+2 H2O═2Na++2OH-+H2↑,,反应后得到的溶液中溶质是NaOH,溶质的质量分数为8%,若要计算该溶液中溶质的物质的量浓度,则还需要溶液密度(填物理量).
(4)若在电解水后收集到O2体积为22.4mL(在标准状况下),则收集到的H2的质量0.004g.
 水是人类宝贵的自然资源,也是一种重要的化工原料.如图是电解水原理的实验装置图.
水是人类宝贵的自然资源,也是一种重要的化工原料.如图是电解水原理的实验装置图.(1)写出电解水的化学方程式,若为氧化还原反应,请用双线桥表示出电子的转移方向和数目.
 .
.(2)假设电解了3.6gH2O,请完成下表.
| 质 量 | 物质的量 | O2与H2的体积比(同温同压下) | |
| O2 | 3.2g | 0.1mol | 1:2 |
| H2 | 0.4g | 0.2mol |
(4)若在电解水后收集到O2体积为22.4mL(在标准状况下),则收集到的H2的质量0.004g.
3.全钒液流电池是一种新型的绿色环保储能电池.其电池总反应为:V3++VO2++H2O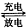 VO2++2H++V2+..下列说法正确的是( )
VO2++2H++V2+..下列说法正确的是( )
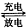 VO2++2H++V2+..下列说法正确的是( )
VO2++2H++V2+..下列说法正确的是( )| A. | 放电时正极反应为:VO${\;}_{2}^{+}$+2H++e-═VO2++H2O | |
| B. | 充电过程中,H+由阴极区向阳极区迁移 | |
| C. | 放电过程中电子由负极经外电路移向正极,再由正极经电解质溶液移向负极 | |
| D. | 充电时阴极反应为:V2+-e-═V3+ |
4.关于酸和碱的下列叙述,正确的是( )
| A. | 凡是组成中含有氢元素的化合物都属于酸 | |
| B. | 凡是组成中含有OH-的化合物都属于碱 | |
| C. | 酸和碱中至少含有一种相同的元素 | |
| D. | 酸和碱中都含有金属阳离子和阴离子 |


 c”或“d”)
c”或“d”)
 以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。写出该反应的化学方程式 。
以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。写出该反应的化学方程式 。