题目内容
2.将等物质的量的A、B、C、D四种物质混合于1L的密闭容器中,发生如下反应:aA(g)+bB(g)?cC(g)+dD,当反应进行10s后,测得A减少了1mol,B减少了0.5mol,C增加了1.5mol,D增加了1mol,此时达到化学平衡.请填写下列空白:
(1)该化学方程式各物质的化学计量数为a=2、b=1、c=3、d=2.
(2)10s内,用B物质表示该反应的速率为0.05mol/(L•s)
(3)若只改变压强,反应速率发生变化,但平衡不发生移动,该反应中物质D的聚集状态为液体或固体.
(4)若只升高温度,反应一段时间后,测知四种物质其物质的量又达到相等,则正反应为放热反应(填“放热”或“吸热”).
分析 (1)根据同一化学反应的同一时间段内,参加反应的各物质的物质的量与计量数的关系判断;
(2)根据v=$\frac{\frac{△n}{V}}{△t}$计算;
(3)根据压强对平衡的影响可知,若只改变压强,反应速率发生变化,但平衡不发生移动,说明反应前后气体的体积不变;
(4)反应一段时间后,测知四种物质其物质的量又达到相等,说明A、B的物质的量增加了,C、D的物质的量减少了,即平衡向逆反应方程移动,根据温度对化学平衡的影响判断;
解答 解:(1)同一化学反应的同一时间段内,参加反应的各物质的物质的量之比等于其计量数之比,所以a:b:c:d=1mol:0.5mol:1.5mol:1mol=2:1:3:2,
故答案为:2;1;3;2.
(2)根据v=$\frac{\frac{△n}{V}}{△t}$可知,10s内,用B物质表示该反应的速率为$\frac{\frac{0.5mol}{1L}}{10s}$=0.05mol/(L•s),
故答案为:0.05mol/(L•s);
(3)根据压强对平衡的影响可知,若只改变压强,反应速率发生变化,但平衡不发生移动,说明反应前后气体的体积不变,由于A、B、C都是气体,且A、B的计量数等于C的计量数,所以D为液体或固体,
故答案为:液体或固体;
(4)反应一段时间后,测知四种物质其物质的量又达到相等,说明A、B的物质的量增加了,C、D的物质的量减少了,即平衡向逆反应方程移动,而升高温度平衡向吸热方程移动,所以该 反应的正反应为放热反应,
故答案为:放热.
点评 本题考查了外界条件对化学平衡的影响适用范围:1、浓度对化学平衡的影响适用于气体或液体;2、压强对化学平衡的影响适用于有气体参加且反应前后气体体积变化的反应;3、温度对所有可逆反应都有影响,无论该反应放热还是吸热,题目难度中等.

| A. | 用澄清石灰水鉴别氮气和二氧化碳 | |
| B. | 用肥皂水鉴别硬水和软水 | |
| C. | 用闻气味的方法鉴别白酒和白醋 | |
| D. | 用稀盐酸鉴别碳酸钠粉末和碳酸钙粉末 |
| A. | NH3、CuS、SO2、FeS | B. | SO3、Cu2S、FeI2、FeCl3 | ||
| C. | FeCl3、SO2、NO、Cu2S | D. | FeCl2、FeS、SO2、FeI3 |
| 选项 | 叙述I | 叙述II |
| A | 锌金属活动性比铁强 | 海轮外壳上装锌块可减缓腐蚀 |
| B | Ba(OH)2可与盐酸反应 | Ba(OH)2可用于治疗胃酸过多 |
| C | SiO2是酸性氧化物 | SiO2能与水反应生成硅酸 |
| D | H2O2有氧化性 | H2O2能使酸性高锰酸钾溶液褪色 |
| A. | A | B. | B | C. | C | D. | D |
 2NO2 △H > 0)
2NO2 △H > 0)
 证氯、碳、硅三种元素的非金属性
证氯、碳、硅三种元素的非金属性 实验中,至少要用天平称量三次质量
实验中,至少要用天平称量三次质量 含铵根离子。
含铵根离子。 正盐.
正盐.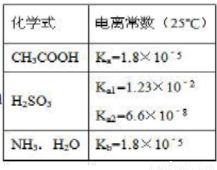
 OOH) =c (CH3COO-
OOH) =c (CH3COO- ) +2c (OH-)
) +2c (OH-)