题目内容
1.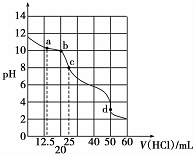 在常温下,0.1000mol•L-1Na2CO3溶液25mL用0.1000mol•L-1盐酸滴定,其滴定曲线如图所示,对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )
在常温下,0.1000mol•L-1Na2CO3溶液25mL用0.1000mol•L-1盐酸滴定,其滴定曲线如图所示,对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )| A. | a点:c(CO32-)=c(HCO3-)>c(OH-) | B. | b点:5c(Cl-)>4c( HCO3-)+4c(CO32-) | ||
| C. | c点:c( OH -)=c(H+)+c(HCO3-)+2c(H2CO3) | D. | d点:c(H+)=c(CO32-)+c( HCO3-)+c(OH -) |
分析 A.a点时n(HCl)=0.1mol/L×0.0125L=0.00125mol,反应生成0.00125molNaHCO3,剩余0.00125molNa2CO3,从盐类的水解程度的角度分析;
B.溶液中存在物料守恒,从物料守恒的角度分析;
C.c点时n(HCl)=0.1mol/L×0.025L=0.0025mol,恰好完全反应生成NaHCO3;
D.溶液中满足电荷守恒,根据电荷守恒的角度分析.
解答 解:A.a点时n(HCl)=0.1mol/L×0.0125L=0.00125mol,反应生成0.00125molNaHCO3,剩余0.00125molNa2CO3,由于水解程度大于电离程度,则c(HCO3-)>c(CO32-),故A错误;
B.b点时n(HCl)=0.1mol/L×0.02L=0.002mol,由物料守恒可知:5c(Cl-)=4c(HCO3-)+4c(CO32-)+4c(H2CO3),则5c(Cl-)>4c(HCO3-)+4c(CO32-),故B正确;
C.c点时n(HCl)=0.1mol/L×0.025L=0.0025mol,恰好完全反应生成NaHCO3,由于HCO3-水解程度较弱,则有c(HCO3-)>c(OH-),故C错误;
D.d点时加入盐酸0.005mol,溶液中溶由反应生成的CO2,溶液存在电荷守恒,存在c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)+c(Cl-),由于c(Na+)=c(Cl-),则 c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),故D错误;
故选B.
点评 本题综合考查离子浓度的大小比较,题目难度较大,本题注意分析反应物的物质的量之间的关系,判断反应的程度以及溶液的主要成分,结合盐类水解的原理解答.

| A. | 相对分子质量相同,组成元素也相同的化合物一定是同分异构体 | |
| B. | 凡是分子组成相差一个或若干个CH2原子团的物质,彼此一定是同系物 | |
| C. | 两种物质的组成元素相同,各元素的质量分数也相同,则两者一定是同分异构体 | |
| D. | 分子式相同的不同有机物一定互为同分异构体 |
| A. | NH4+、Ba2+、Cl-、AlO2- | B. | SO42-、NO3-、Fe2+、Al3+ | ||
| C. | Cl-、SO32-、Na+、K+ | D. | Na+、K+、ClO-、Cl- |
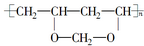 ,它是由聚乙烯醇
,它是由聚乙烯醇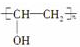 与另一单体经缩聚反应得到的.若已知缩合过程中有H2O生成,则与聚乙烯醇缩合的单体可能是( )
与另一单体经缩聚反应得到的.若已知缩合过程中有H2O生成,则与聚乙烯醇缩合的单体可能是( )| A. | CH3OH | B. | HCHO | C. | HO-CH2CH2-OH | D. | HCOOH |
(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
2C(s)+O2(g)=2CO(g)△H=-221.0kJ/mol
C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol
试写出NO与CO催化转化成N2和CO2的热化学方程式2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5kJ•mol-1
(2)某研究性学习小组在技术人员的指导下,在某温度时,按下列流程探究某种催化剂对上述转化反应的作用,用气体传感器测得不同时间的NO和CO浓度如下:
汽车尾气→尾气分析仪→催化反应器→尾气分析仪
| 时间/S | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)(×10-4mol•L-1) | 10.0 | 4.05 | 2.50 | 1.50 | 1.00 | 1.00 |
| C(CO) (×10-3mol•L-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
①前2s内的平均反应速率v (N2)=1.875×10-4mol/L.s.
②在该温度下,反应的平衡常数K=5000.(只写出计算结果)
(3)在容积相同的两个密闭容器内(装有等量的某种催化剂),分别充入同量的NOx及C3H6,在不同温度下,同时分别发生以下反应:
18NO(g)+2C3H6(g)?9N2(g)+6CO2(g)+6H2O(g);
18NO2(g)+4C3H6(g)?9N2(g)+12CO2(g)+12H2O(g);
并分别测定各温度下经相同时间时的NOx转化率,绘得图象如图1所示:
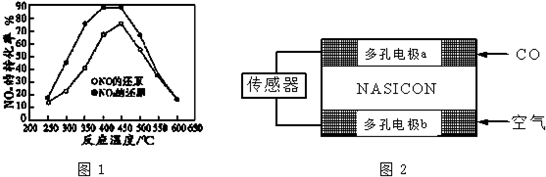
①分析图中信息可以得出的结论是
结论一:由NOX转化率数据可判断,相同温度下NO的转化率比NO2低(填“高”或“低”)
结论二:在250°C~450°C时,NOx转化率随温度升高而增大,450°C~600°时NOx转化率随温度升高而减小或两反应为放热反应
②在上述NO2和C3H6的反应中,能提高NO2转化率的措施有BC.(填序号)
A.加入催化剂 B.降低温度 C.分离出H2O(g) D.增大压强
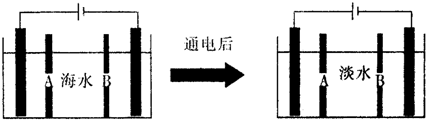
(4)CO分析仪以燃料电池为工作原理,其装置如图2所示.该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动.工作时多孔电极a的电极反应方程式为CO+O2--2e-=CO2.
.
| A. | 四种元素中原子半径最大的为Z | |
| B. | Y、Z、M的氢化物中,M的氢化物最稳定 | |
| C. | 四种元素最多可形成两种盐 | |
| D. | 由四种元素中的两种形成的相对分子质量最小的有机物不能发生加成反应 |
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
| 含量/mg•L-1 | 9360 | 83 | 160 | 1100 | 16000 | 1200 | 118 |
(2)下面是海水利用电渗析法获得淡水的原理图,电极为惰性电极.请分析下列问题:
①阳离子交换膜是指B(填A或B).
②写出通电后阳极区的电极反应式:2Cl--2e-=Cl2↑.电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式Ca2++OH-+HCO3-=CaCO3↓+H2O.
(3)水的净化与软化的区别是水的净化是用混凝剂(如明矾等)将水中悬浮物沉淀下来,而水的软化是除去水中的钙离子和镁离子;离子交换法是软化水的常用方法,聚丙烯酸钠是一种离子交换树脂,写出聚丙烯酸钠单体的结构简式CH2=CHCOONa.
(4)采用“空气吹出法”从浓海水中吹出Br2,并用纯碱吸收.碱吸收溴的主要反应是:Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3,吸收80g Br2时转移的电子为$\frac{5}{6}$mol.