题目内容
14.现有反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,在850℃时,K=1.850℃时,若向一容积可变的密闭容器中同时充入1.0mol CO,3.0mol H2O,1.0mol CO2和5.0mol H2,则化学反应速率是v正小于v逆(填“大于”、“小于”或“等于”).分析 充入1.0mol CO,3.0mol H2O,1.0mol CO2和5.0mol H2,Qc=$\frac{\frac{1.0}{V}mol/L×\frac{5.0}{V}mol/L}{\frac{1.0}{V}mol/L×\frac{3.0}{V}mol/L}$=$\frac{5}{3}$>K=1.0,以此来解答.
解答 解:充入1.0mol CO,3.0mol H2O,1.0mol CO2和5.0mol H2,Qc=$\frac{\frac{1.0}{V}mol/L×\frac{5.0}{V}mol/L}{\frac{1.0}{V}mol/L×\frac{3.0}{V}mol/L}$=$\frac{5}{3}$>K=1.0,则平衡逆向移动,v正小于v逆,
故答案为:小于.
点评 本题考查化学平衡的计算,为高频考点,把握Qc与K的关系、平衡移动为解答的关键,侧重分析与计算能力的考查,注意浓度商Qc的应用,题目难度不大.

练习册系列答案
相关题目
17.(1)甲同学利用下列装置来进行铜跟浓硫酸反应实验.
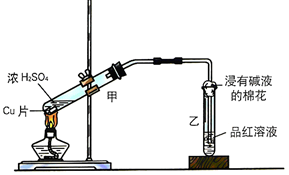
①写出甲装置中发生的主要反应的化学方程式Cu+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
②乙同学认为,若要用铜制取硫酸铜,可以先用铜和氧气反应生成氧化铜,然后利用氧化铜和稀硫酸反应可以得到硫酸铜.若要制取硫酸铜,请你从环境保护和节约资源的角度分析,比较甲同学和乙同学制取硫酸铜的方法中更合理的是乙,原因是甲有二氧化硫产生,污染空气,乙无污染,硫酸利用率高.
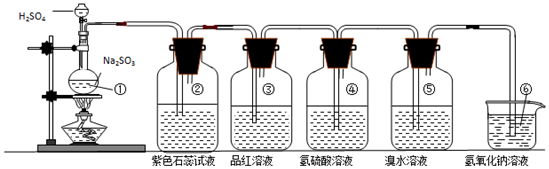
(2)丙同学利用下图的方法实验室制取并验证SO2某些性质,并将实验情况记录在表中,请完成以下表格:

①写出甲装置中发生的主要反应的化学方程式Cu+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
②乙同学认为,若要用铜制取硫酸铜,可以先用铜和氧气反应生成氧化铜,然后利用氧化铜和稀硫酸反应可以得到硫酸铜.若要制取硫酸铜,请你从环境保护和节约资源的角度分析,比较甲同学和乙同学制取硫酸铜的方法中更合理的是乙,原因是甲有二氧化硫产生,污染空气,乙无污染,硫酸利用率高.

(2)丙同学利用下图的方法实验室制取并验证SO2某些性质,并将实验情况记录在表中,请完成以下表格:
| 装置序号 | 实验现象或作用 | 实验结论或化学方程式 |
| ① | 有气泡产生 | 化学方程式为:Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑ |
| ② | 紫色石蕊试液变红色 | 证明SO2溶于水显酸性 |
| ③ | 品红溶液褪色 | 证明SO2具有漂白性 |
| ④ | 溶液变浑浊 | 证明SO2具有氧化性 |
| ⑤ | 溴水褪色 | 证明SO2具有还原性 |
| ⑥ | 吸收尾气 | 证明SO2属于酸性氧化物 |
3.下列反应中反应物键能总和高于生成物键能总和的是( )
| A. | 碳酸钙受热分解 | B. | 乙醇的燃烧 | ||
| C. | 铝粉与氧化铁粉末反应 | D. | 氧化钙与水反应 |
4.下列仪器不能用于加热的是( )
| A. | 容量瓶 | B. | 蒸馏烧瓶 | C. | 试管 | D. | 烧杯 |
 ;A加聚产物的结构简式是
;A加聚产物的结构简式是 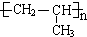 .
.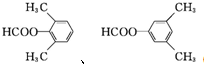 .
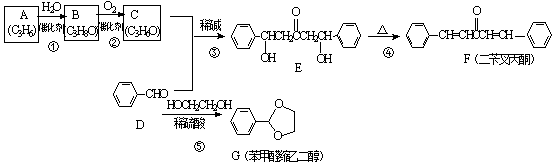
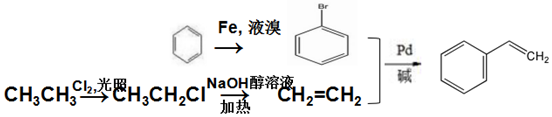
.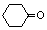 (环已酮)合成
(环已酮)合成 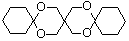 [已知HCHO是所有醛中还原性最强的(常用Ca(OH)2催化剂)]
[已知HCHO是所有醛中还原性最强的(常用Ca(OH)2催化剂)]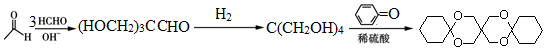 .
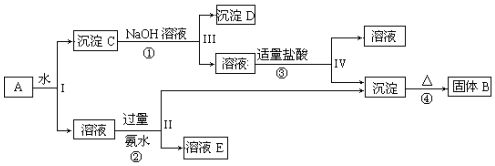
.
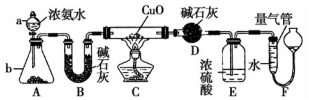 某课外活动小组欲利用CuO与NH4反应,研究NH3的某种性质并测定其组成,设计了如图实验装置(夹持装置未画出)进行实验.请回答下列问题:
某课外活动小组欲利用CuO与NH4反应,研究NH3的某种性质并测定其组成,设计了如图实验装置(夹持装置未画出)进行实验.请回答下列问题: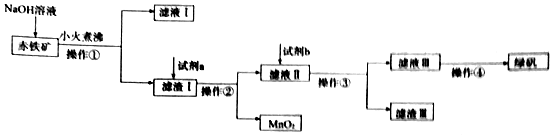

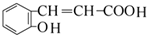 .
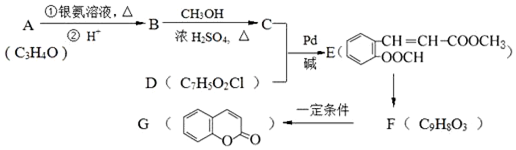
.
 .
.