题目内容
18.某同学设计如图实验方案,以分离KCl和BaCl2两种固体混合物.试回答下列问题.
(1)B物质的化学式为BaCl2.
(2)该方案的明显失误是因某一步设计不当而使分离产物不纯,该步骤是⑥(填序号),如何改进步骤⑥应在溶液中加过量盐酸,然后再蒸发结晶,所涉及的离子方程式为2H++CO32-=CO2↑+H2O.
(3)写出②、④两步反应中对应的化学方程式:
②Ba2++CO32-=BaCO3↓; ④BaCO3+2H+=Ba2++CO2↑+H2O.
分析 分离KCl和BaCl2两种固体混合物,可先溶于水,然后加入过量K2CO3使BaCl2转化为A碳酸钡沉淀,过滤后沉淀加入盐酸可生成BaCl2溶液,经⑤蒸发、结晶后可得固体B为BaCl2,操作②所得滤液为KCl和K2CO3的混合物,应加入过量盐酸可得KCl,固体C为KCl,以此解答该题.
解答 解:分离KCl和BaCl2两种固体混合物,可先溶于水,然后加入过量K2CO3使BaCl2转化为A碳酸钡沉淀,过滤后沉淀加入盐酸可生成BaCl2溶液,经⑤蒸发、结晶后可得固体B为BaCl2,操作②所得滤液为KCl和K2CO3的混合物,应加入过量盐酸可得KCl,固体C为KCl,
(1)氯化钾和氯化钡溶液中加入碳酸钾溶液可以生成碳酸钡沉淀,则沉淀A为BaCO3;过滤后碳酸钡沉淀中加入盐酸可生成BaCl2溶液,经⑤蒸发、结晶后可得B固体BaCl2,故答案为:BaCl2;
(2)蒸发结晶前应加入适量稀盐酸,将过量的碳酸钾转化成氯化钾,否则晶体不纯,可知步骤⑥操作不当,改进后发生的离子反应为2H++CO32-=CO2↑+H2O,
故答案为:⑥;步骤⑥应在溶液中加过量盐酸,然后再蒸发结晶;2H++CO32-=CO2↑+H2O;
(3)②加入碳酸钾生成碳酸钡沉淀,反应的化学方程式为K2CO3+BaCl2=BaCO3↓+2KCl,④为碳酸钡和盐酸的反应,方程式为BaCO3↓+2HCl=BaCl2+CO2↑+H2O,离子反应分别为Ba2++CO32-=BaCO3↓、BaCO3+2H+=Ba2++CO2↑+H2O,
故答案为:Ba2++CO32-=BaCO3↓;BaCO3+2H+=Ba2++CO2↑+H2O.
点评 本题考查混合物分离提纯实验,为高频考点,把握流程中的化学反应及混合物分离方法为解答的关键,侧重分析与实验能力的考查,题目难度不大.

| A. | 2Na+2H2O=2 NaOH+H2↑ | B. | Cl2+H2O=HCl+HClO | ||
| C. | CaCO3=CaO+CO2↑ | D. | Ca(ClO)2+2HCl=CaCl2+2HClO |

| A. | .m+n>p△H>0 | B. | m+n<p△H>0 | C. | .m+n>p△H<0 | D. | m+n<p△H<0 |
| A. | 醋酸钠中加入盐酸:CH3COONa+H+→CH3COOH+Na+ | |
| B. | 在硫酸作催化剂、加热条件下乙烯与水发生加成反应:CH2═CH2+H2O $→_{△}^{H_{2}SO_{4}}$ CH3CH2OH | |
| C. | 甲醛溶液中加入足量的银氨溶液并加热: HCHO+2[Ag(NH3)2]++2OH-$\stackrel{水浴加热}{→}$HCOO-+NH4++2Ag↓+3NH3+H2O | |
| D. | 2分子甘氨酸 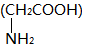 在一定条件下脱去2分子水: 在一定条件下脱去2分子水: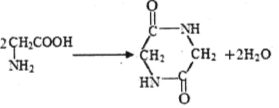 |
| A. | v(A)=0.7mol•L-1•min-1 | B. | v (B)=0.3mol•L-1•min-1 | ||
| C. | v (C)=0.9mol•L-1•min-1 | D. | v (D)=0.8mol•L-1•s-1 |
 溶液加入到120mL盐酸中,所得溶液的pH为2。如果混合前氢氧化钠溶液和盐酸的物质的量浓度相同,它们的浓度是 ( )
溶液加入到120mL盐酸中,所得溶液的pH为2。如果混合前氢氧化钠溶液和盐酸的物质的量浓度相同,它们的浓度是 ( ) H2CO3-+2OH-
H2CO3-+2OH- OH-
OH-