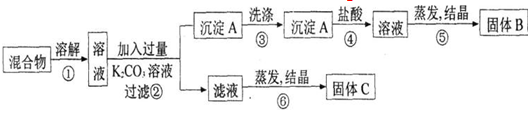
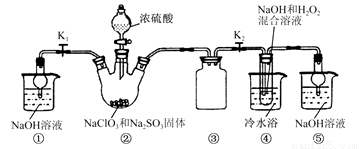
题目内容
11.某可逆反应:mA(气)+nB(气)?pC(气)(焓变为△H),其温度T、时间t与生成物C的体积百分数C%、平衡混合气体的平均相对分子质量M的关系如图所示,下列结论正确的是( )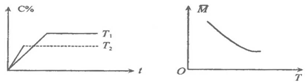
| A. | .m+n>p△H>0 | B. | m+n<p△H>0 | C. | .m+n>p△H<0 | D. | m+n<p△H<0 |
分析 根据“先拐先平数值大”知,左图中T2>T1,升高温度C的含量减小,说明平衡向逆反应方向移动,则正反应是放热反应;
根据右图知,升高温度,平衡向逆反应方向移动,平均相对分子质量减小,因为反应前后质量不变,则说明逆反应方向为气体体积增大的方向,据此分析解答.
解答 解:根据“先拐先平数值大”知,左图中T2>T1,升高温度C的含量减小,说明平衡向逆反应方向移动,则正反应是放热反应,所以△H<0;
根据右图知,升高温度,平衡向逆反应方向移动,平均相对分子质量减小,因为反应前后质量不变,则说明逆反应方向为气体体积增大的方向应,则m+n>p;
故选C.
点评 本题考查可逆反应中温度对化学平衡影响图象分析,采用“先拐先平数值大”原则分析即可,同时考查学生分析问题能力,题目难度不大.

练习册系列答案
相关题目
3.下列说法不正确的是( )
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 化学变化过程是原子的重新组合过程 | |
| C. | 生成物总能量高于反应物总能量的反应是吸热反应 | |
| D. | 反应是放热还是吸热必须看反应物和生成物所具有的总能量的相对大小 |
2.高炉炼铁过程中发生反应:$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如表,下列说法正确的是( )
| 温度/°C | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
| A. | △H>0 | |
| B. | 1000℃时,在固定体积的密闭容器中,某时刻测得上述体系中,CO、CO2的物质的量分别为0.5mol、1.8mol,此时反应向正反应方向进行 | |
| C. | 其他条件不变,向平衡体系充入CO2气体,K值减小 | |
| D. | 其他条件不变,升高温度,可以提高CO的平衡转化率 |

 浓度为0.1 mol·L-1 HF
浓度为0.1 mol·L-1 HF 溶液加水不断稀释,下列各
溶液加水不断稀释,下列各 量始终保持增大的是( )
量始终保持增大的是( )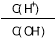 D.
D.