题目内容
现有1.0mol/L的NaOH溶液0.1L,若通入标准状况下体积为2.24L 的SO2气体,使其充分反应后,则所得溶液中各粒子浓度大小关系正确的是( )
| A、c(Na+)+c(H+)=c(HSO3-)+c(SO32-)+c( OH-) |
| B、c(Na+)=c(H2SO3)+c(HSO3-)+c( H+) |
| C、c(SO32-)+c( OH-)=c(H+)+c(H2SO3) |
| D、c(Na+)>c(HSO3-)>c( OH-)>c(H2SO3)>c(SO32-)>c(H+) |
考点:离子浓度大小的比较
专题:电离平衡与溶液的pH专题
分析:n(NaOH)=1.0mol/L×0.1L=0.1mol,n(SO2)=
=0.1mol,二者的物质的量之比为1:1,则二者恰好反应生成NaHSO3,溶液中存在电荷守恒和物料守恒,据此分析解答.
| 2.24L |
| 22.4L/mol |
解答:
解:n(NaOH)=1.0mol/L×0.1L=0.1mol,n(SO2)=
=0.1mol,二者的物质的量之比为1:1,则二者恰好反应生成NaHSO3,
A.溶液中存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c( OH-),故A错误;
B.溶液中存在物料守恒,根据物料守恒得c(Na+)=c(H2SO3)+c(HSO3-)+c(SO32-),故B错误;
C.根据电荷守恒得c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c( OH-),根据物料守恒得c(Na+)=c(H2SO3)+c(HSO3-)+c(SO32-),所以得c(SO32-)+c( OH-)=c(H+)+c(H2SO3),故C正确;
D.溶液中HSO3- 电离程度大于水解程度导致溶液呈酸性,但电离和水解程度都较小,水还电离生成氢氧根离子,所以c(H2SO3)<c(SO32-),故D错误;
故选C.
| 2.24L |
| 22.4L/mol |
A.溶液中存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c( OH-),故A错误;
B.溶液中存在物料守恒,根据物料守恒得c(Na+)=c(H2SO3)+c(HSO3-)+c(SO32-),故B错误;
C.根据电荷守恒得c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c( OH-),根据物料守恒得c(Na+)=c(H2SO3)+c(HSO3-)+c(SO32-),所以得c(SO32-)+c( OH-)=c(H+)+c(H2SO3),故C正确;
D.溶液中HSO3- 电离程度大于水解程度导致溶液呈酸性,但电离和水解程度都较小,水还电离生成氢氧根离子,所以c(H2SO3)<c(SO32-),故D错误;
故选C.
点评:本题考查离子浓度大小比较,正确判断溶液中的溶质是解本题关键,侧重考查学生分析问题能力,知道任何电解质溶液中都存在物料守恒和电荷守恒,易错选项是D.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列关于氨碱法(索氏)和联合制碱法(侯氏)说法错误的是( )
| A、两者的原料来源相同 |
| B、两者的生产原理相同 |
| C、两者对食盐利用率不同 |
| D、两者最终产品都是Na2CO3 |
 四种短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中D形成的两种氧化物都是大气污染物.下列有关判断正确的是( )
四种短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中D形成的两种氧化物都是大气污染物.下列有关判断正确的是( )| A、简单氢化物的热稳定性:C>A |
| B、最高价氧化物对应水化物的酸性:D<C |
| C、B的最高价氧化物的水化物能与D的最高价氧化物的水化物反应 |
| D、A、C、D的最高价含氧酸的钠盐水溶液可能均显碱性 |
下列实验方案设计合理且能达到相应实验预期目的是( )
A、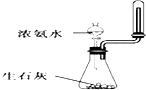 制取少量氨气 |
B、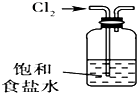 除去氯气中的HCl杂质 |
C、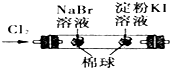 证明氧化性Cl2>Br2>I2 |
D、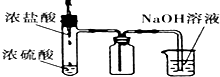 制取HCl且除去多余的气体 |
某强酸性溶液中可能存在NO3-、I-、Cl-、Fe3+中的一种或几种.向该溶液中加入溴水后,溴被还原,由此推断该溶液中( )
| A、不含NO3-,也不含Fe3+ |
| B、含有NO3-、I-、Cl? |
| C、含I-,且肯定含有Cl- |
| D、可能含有Fe3+ |
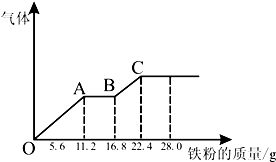 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体),向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图,下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体),向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图,下列分析或结果错误的是( )| A、H2SO4浓度为4mol?L-1 |
| B、OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气 |
| C、每份混合酸中NO3-物质的量为0.3mol |
| D、第二份溶液中最终溶质为FeSO4 |
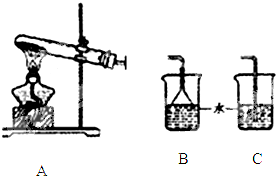 某研究性学习小组为了制取并探究氨气的性质,进行以下实验.[装置A中发生反应的化学方程式:2NH4Cl+Ca(OH)2
某研究性学习小组为了制取并探究氨气的性质,进行以下实验.[装置A中发生反应的化学方程式:2NH4Cl+Ca(OH)2