题目内容
16.二氧化氯(ClO2)是国际上公认的安全、无毒的绿色消毒剂,对酸性污水中的Mn2+也有明显的去除效果,其反应原理为:ClO2+Mn2+→MnO2↓+Cl- (部分反应物和产物省略、未配平),下列有关该反应的说法正确的是( )| A. | 工业上可用更为廉价的Cl2来代替ClO2 | |
| B. | 利用该原理处理含Mn2+的污水后溶液的pH升高 | |
| C. | 该反应中氧化产物和还原产物的物质的量之比为2:5 | |
| D. | 理论上处理含1mol Mn2+的污水,需要标准状况下的ClO28.96L |
分析 二氧化氯(ClO2)对酸性污水中的Mn2+也有明显的去除效果,其反应原理为:ClO2+Mn2+→MnO2↓+Cl-,根据得失电子守恒和电荷守恒补全反应方程式为:
2ClO2+5Mn2++6H2O=5MnO2↓+2Cl-+12H+,其中ClO2为氧化剂,生成2Cl- 为还原产物,Mn2+为还原剂,生成MnO2为氧化产物,据此分析解答.
解答 解:A.因为氯气有毒并且氧化效果没有ClO2好,故A错误;
B.由2ClO2+5Mn2++6H2O=5MnO2↓+2Cl-+12H+,所以处理含Mn2+的污水后溶液的pH降低,故B错误;
C.由2ClO2+5Mn2++6H2O=5MnO2↓+2Cl-+12H+,其中ClO2为氧化剂,生成2Cl- 为还原产物,Mn2+为还原剂,生成5MnO2为氧化产物,所以该反应中氧化产物和还原产物的物质的量之比为5:2,故C错误;
D.由2ClO2+5Mn2++6H2O=5MnO2↓+2Cl-+12H+,则理论上处理含1mol Mn2+的污水,需要标准状况下的ClO2为$\frac{2}{5}$×22.4=8.96L,故D正确.
故选D.
点评 本题考查氧化还原反应,明确反应中的基本概念,并学会利用元素的化合价变化来分析补全氧化还原反应方程式以及氧化剂、还原剂等,难度不大.

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
6.用可溶性钡盐检验SO42-离子的存在时,先在待测溶液中加入盐酸,其作用是( )
| A. | 形成较多的白色沉淀 | |
| B. | 形成的沉淀纯度更高 | |
| C. | 排除Ba2+以外的其它阳离子的干扰 | |
| D. | 排除SO42-以外的其它阴离子及Ag+的干扰 |
7.以下处理方法正确的是( )
| A. | 金属钠着火,用水或CO2灭火器灭火 | |
| B. | 少量白磷保存在煤油中 | |
| C. | 不小心把水银洒落在地面,盖沙处理 | |
| D. | 硝酸银保存在棕色试剂瓶中 |
4.X、Y、Z、W是短周期主族元素,X原子最外层电子数是次外层的两倍,Y元素在地壳中的含量最多,Z元素的金属性最强,W原子的核外电子数是X原子与Z原子的核外电子数之和.下列叙述正确的是( )
| A. | X、Y、Z形成的化合物不止一种 | |
| B. | X的氢化物比Y的氢化物稳定 | |
| C. | 原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X) | |
| D. | Y与Z或W形成的化合物中只含离子键 |
1.用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 8.4gNaHCO3晶体中含有0.1NA个CO32- | |
| B. | 常温常压下,32g臭氧所含的氧原子数为2NA | |
| C. | 0.1molFe与过量硝酸反应,转移电子数为0.2NA | |
| D. | 1molCH4与1molCl2在光照下反应,生成CH3Cl的分子数为NA |
8.有机物A是一种重要的化工原料,其结构简式为: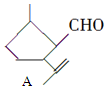 ,下列检验A中官能团的试剂和顺序正确的是( )
,下列检验A中官能团的试剂和顺序正确的是( )
 ,下列检验A中官能团的试剂和顺序正确的是( )
,下列检验A中官能团的试剂和顺序正确的是( )| A. | 先加溴水,再加KMnO4酸性溶液 | |
| B. | 先加入足量的新制Cu(OH)2悬浊液,微热,酸化后再加溴水 | |
| C. | 先加银氨溶液,微热,再加溴水 | |
| D. | 先加KMnO4酸性溶液,再加银氨溶液,微热 |
5.用CCl4 把碘从碘水中提取出来的方法是( )
| A. | 萃取 | B. | 过滤 | C. | 蒸发 | D. | 蒸馏 |
6.在不同浓度(℃)、温度(T)条件下,蔗糖水解的瞬时速率(v)如下表,下列判断不正确的是( )
 | 0.600 | 0.500 | 0.400 | a |
| 318.2 | 3.60 | c | 2.40 | 1.80 |
| 328.2 | 9.00 | 7.50 | d | 4.50 |
| b | 2.16 | 1.80 | 1.44 | 1.08 |
| A. | a<0.400 | B. | c>2.40 | C. | b<318.2 | D. | d<1.44 |