题目内容
4.X、Y、Z、W是短周期主族元素,X原子最外层电子数是次外层的两倍,Y元素在地壳中的含量最多,Z元素的金属性最强,W原子的核外电子数是X原子与Z原子的核外电子数之和.下列叙述正确的是( )| A. | X、Y、Z形成的化合物不止一种 | |
| B. | X的氢化物比Y的氢化物稳定 | |
| C. | 原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X) | |
| D. | Y与Z或W形成的化合物中只含离子键 |
分析 X、Y、Z、W是短周期主族元素,X原子最外层电子数是次外层的两倍,则X为C元素;Y元素在地壳中的含量最多,Y为O元素;Z元素的金属性最强,Z为Na元素;W原子的核外电子数是X原子与Z原子的核外电子数之和,则W的电子数为6+11=17,即W为Cl,以此来解答.
解答 解:由上述分析可知,X为C,Y为O,Z为Na,W为Cl,
A.X、Y、Z形成的化合物有碳酸钠、CO、二氧化碳、氧化钠、过氧化钠等,故A正确;
B.非金属性Y>X,则Y氢化物比X的氢化物稳定,故B错误;
C.电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径的大小顺序:r(Z)>r(W)>r(X)>r(Y),故C错误;
D.Y与Z形成氧化钠只含离子键,形成过氧化钠含离子键和共价键,而Y与W形成的化合物中只含共价键,故D错误;
故选A.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的性质、原子结构、电子数关系推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
14.石墨和金刚石都是碳的单质,石墨在一定条件下可转化为金刚石.已知把石墨完全转化为金刚石时,要吸收能量,下列说法正确的是( )
| A. | 石墨不如金刚石稳定 | |
| B. | 石墨转变成金刚石是物理变化 | |
| C. | 等质量的金刚石与石墨完全燃烧,放出的能量一样多 | |
| D. | 等质量的金刚石与石墨完全燃烧,金刚石放出的能量多 |
15.下列关于物质的量的表述中不正确的是( )
| A. | 1.5 mol H2O和2.5 mol水 | B. | 2 mol H2SO4 和 5 mol硫酸 | ||
| C. | 1.2 mol H2 和1.6 mol 氢 | D. | 10 mol Ne 和 12mol 氖原子 |
19.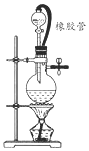 在氯气的制备实验中,有位同学设计了如图所示的制备装置,其中分液漏斗与烧瓶瓶塞之间连接一段橡胶管和玻璃管.下列对其作用的叙述中正确的是( )
在氯气的制备实验中,有位同学设计了如图所示的制备装置,其中分液漏斗与烧瓶瓶塞之间连接一段橡胶管和玻璃管.下列对其作用的叙述中正确的是( )
 在氯气的制备实验中,有位同学设计了如图所示的制备装置,其中分液漏斗与烧瓶瓶塞之间连接一段橡胶管和玻璃管.下列对其作用的叙述中正确的是( )
在氯气的制备实验中,有位同学设计了如图所示的制备装置,其中分液漏斗与烧瓶瓶塞之间连接一段橡胶管和玻璃管.下列对其作用的叙述中正确的是( )| A. | 防止氯气造成大气污染 | |
| B. | 使反应的氯气循环使用 | |
| C. | 使烧瓶内的压强与大气压保持一致 | |
| D. | 使分液漏斗中的液体更容易注入烧瓶 |
16.二氧化氯(ClO2)是国际上公认的安全、无毒的绿色消毒剂,对酸性污水中的Mn2+也有明显的去除效果,其反应原理为:ClO2+Mn2+→MnO2↓+Cl- (部分反应物和产物省略、未配平),下列有关该反应的说法正确的是( )
| A. | 工业上可用更为廉价的Cl2来代替ClO2 | |
| B. | 利用该原理处理含Mn2+的污水后溶液的pH升高 | |
| C. | 该反应中氧化产物和还原产物的物质的量之比为2:5 | |
| D. | 理论上处理含1mol Mn2+的污水,需要标准状况下的ClO28.96L |
13.市场上经常见到的一种电池,总反应式为:Li+2Li0.35NiO2$?_{充电}^{放电}$2Li0.85NiO2.负极材料是金属锂和碳的复合材料.含Li+导电固体为电解质,下列说法正确的是( )
| A. | 放电过程中Li+向正极移动 | |
| B. | 可加入硫酸以提高电解质的导电性 | |
| C. | 充电时,Li+向阳极移动 | |
| D. | 放电时,负极反应式为:2Li0.35NiO2+Li++e-═2Li0.85NiO2 |
14.某溶液可能含有下列6种离子中的某几种:Cl-、SO42-、HCO3-、Na+、K+、Mg2+,所含离子的浓度均相等.为了确认溶液的组成,进行如下实验:
①取100mL上述溶液,加入足量Ba(OH)2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.88g.
②向沉淀中加入过量的盐酸,有2.33g沉淀不溶解.
则下列结论不正确的是( )
①取100mL上述溶液,加入足量Ba(OH)2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.88g.
②向沉淀中加入过量的盐酸,有2.33g沉淀不溶解.
则下列结论不正确的是( )
| A. | 原溶液一定存在SO42-、HCO3-、Mg2+,至少存在Na+、K+中的一种 | |
| B. | 若要证明原溶液中是否存在 Cl-,可在第①步的滤液中加硝酸酸化后再加硝酸银溶液 | |
| C. | 加Ba(OH)2溶液中使原溶液中的离子恰好反应且完全沉淀时,混合液呈中性 | |
| D. | 第②步实验中共消耗0.04mol HCl |

 ;
;